
现有几种元素的性质或原子结构如下表:
元素编号 | 元素性质或原子结构 |
T | 失去一个电子后,形成Ne原子电子层结构 |
X | 最外层电子数是次外层电子数的2倍 |
Y | 其单质之一是空气中主要成分,最常见的助燃剂 |
Z | 形成双原子单质分子,黄绿色气体 |
(1)元素X的一种同位素用来作原子量标准,这种同位素的符号是 ;
(2)画出T的原子结构示意图 ;
(3)写出工业上制取单质Z的化学方程式 ;
(4)写出由T、Y和Z三种元素组成的一种化合物的化学式 ;写出该物质在水中的电离方程式
科目:高中化学 来源:2016届江西省南昌市高三上学期第四次考试化学试卷(解析版) 题型:选择题
美、德两国成功合成具有化学特性的氢铝化合物(AlH3)n,关于氢铝化合物的推测不正确的是
A.氢铝化合物与水反应生成氢氧化铝和氢气
B.与H2O反应生成2.24 LH2(标况下),转移的电子为0.2 mol
C.氢铝化合物中氢显-1价
D.氢铝化合物具有强还原性
查看答案和解析>>
科目:高中化学 来源:2016届福建省高三上学期期中考试化学试卷(解析版) 题型:选择题
下列说法正确的是( )
A.I的原子半径大于Br,HI比HBr的热稳定性强
B.P的非金属性强于Si,H3PO4比H2SiO3的酸性强
C.SO2和SO3混合气体通入Ba(NO3)2溶液可得到BaSO3和BaSO4
D.SiO2既能和氢氧化钠溶液反应也能和氢氟酸反应,所以是两性氧化物
查看答案和解析>>
科目:高中化学 来源:2016届陕西西安第一中学高三上学期期中考试化学试卷(解析版) 题型:选择题
某离子反应中涉及H2O、ClO—、NH4+、H+、N2、Cl—六种微粒。其中N2的物质的量随时间变化的曲线如下图所示。下列判断正确的是

A.该反应的还原剂是Cl—
B.消耗1 mol还原剂,转移6 mol电子
C.氧化剂与还原剂的物质的量之比为2:3
D.反应后溶液的酸性明显增强
查看答案和解析>>
科目:高中化学 来源:2016届宁夏六盘山高级中学高三上学期期中考试化学试卷(解析版) 题型:选择题
根据右图回答,下列说法不正确的是
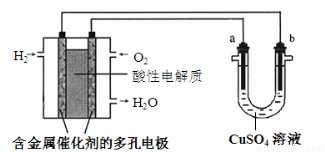
A.此装置用于铁表面镀铜时,a为铁
B.此装置用于电镀铜时,硫酸铜溶液的浓度不变
C.燃料电池中正极反应为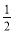 O2(g) + 2e- +2H+=H2O
O2(g) + 2e- +2H+=H2O
D.若a为粗铜,b为纯铜,该装置可用于铜的精炼
查看答案和解析>>
科目:高中化学 来源:2015-2016浙江宁波效实中学高一上期中考试化学试卷(解析版) 题型:选择题
下列实验操作中,所用仪器合理的是
A.用25mL的烧杯量取14.80mL NaOH溶液
B.用100mL的量筒量取5.2mL的盐酸
C.用托盘天平称取25.20g NaCl
D.用100mL容量瓶配制80mL 0.1mol/L的盐酸
查看答案和解析>>
科目:高中化学 来源:2015-2016浙江宁波效实中学高二上期中考试化学试卷卷(解析版) 题型:选择题
在25℃时,用0.125 mol·L-1的标准盐酸溶液滴定25.00 mL未知浓度的NaOH溶液所得滴定曲线如图所示,图中K点代表的pH为

A.13 B.12 C.10 D.11
查看答案和解析>>
科目:高中化学 来源:2016届福建省、霞浦七中、周宁十中高三上期中联考化学试卷(解析版) 题型:选择题
可以大量共存的离子组是
A.Na+、Fe2+、NO3-、Cl-
B.K+、HCO3-、SO42-、OH-
C.ClO-、Cl-、Na+、H+
D.Ba2+、K+、SO42-、H+
查看答案和解析>>
科目:高中化学 来源:2016届山东省威海市乳山市高三上学期期中测试化学试卷(解析版) 题型:填空题
有报道称Co3O4能催化N2O分解,其中27Co在元素周期表中属于铁系元素,其单质及化合物的性质与铁有很多相似之处。
(1)钴元素在周期表中的位置是 ;Co3O4中Co的化合价为 。
(2)Co3O4能与浓盐酸反应生成黄绿色气体,写出反应的化学方程式: 。实验反应中若消耗10mol·L-1浓盐酸40mL,则反应中转移电子 mol,产生气体的标准状况下体积为 mL。
(3)下列关于Co3O4催化N2O分解的说法正确的是 (填序号)。
A.Co3O4作为催化剂使N2O分解反应的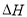 增大
增大
B.Co3O4作为催化剂使N2O分解反应的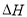 减少
减少
C.Co3O4作为催化剂使N2O分解反应的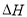 不变
不变
D.Co3O4作为催化剂使N2O分解反应的途径改变,降低了反应所需能量
E.Co3O4作为催化剂使N2O分解反应的途径改变,增加了反应所需能量

(4)实验测得:Co(OH)2在空气中加热时,可得到不同价态的氧化物。固体残留率(剩余固体质量与原始固体质量比率)随温度的变化如图所示。已知钴的氢氧化物加热至290℃时已完全脱水。通过分析数据确定:在B、C之间(500℃—1000℃)范围内,剩余固体成分为: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com