
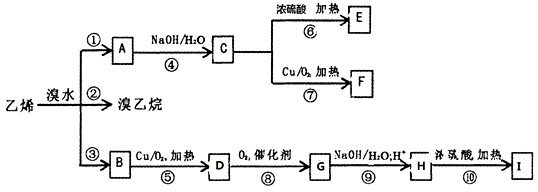
 ,I的分子式为C4H4O4,是一种环状化合物。请回答下列问题:
,I的分子式为C4H4O4,是一种环状化合物。请回答下列问题: 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:高中化学 来源:辽宁省同步题 题型:推断题
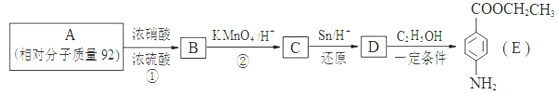
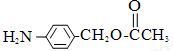 、
、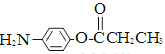 、
、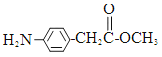 外,符合下列条件的化合物E的同分异构体有___________种
外,符合下列条件的化合物E的同分异构体有___________种 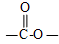 结构的基团
结构的基团 查看答案和解析>>
科目:高中化学 来源:宁夏自治区模拟题 题型:实验题


查看答案和解析>>
科目:高中化学 来源:吉林省期中题 题型:填空题


 分别表示N2、H2、NH3。图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别是__________________、__________________。
分别表示N2、H2、NH3。图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别是__________________、__________________。  7N2+12H2O(NO 也有类似的反应)
7N2+12H2O(NO 也有类似的反应)
查看答案和解析>>
科目:高中化学 来源:模拟题 题型:填空题

 MnFe2O4-x+O2↑、MnFe2O4-x+xH2O →MnFe2O4+xH2↑,请认真分析上述两个反应并回答下列问题:
MnFe2O4-x+O2↑、MnFe2O4-x+xH2O →MnFe2O4+xH2↑,请认真分析上述两个反应并回答下列问题: 查看答案和解析>>
科目:高中化学 来源:辽宁省同步题 题型:填空题

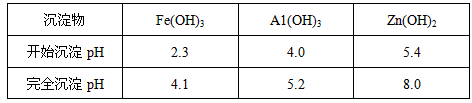
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com