
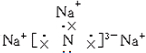 ;该化合物是由离子键形成的离子(填“离子”或“共价”)化合物.
;该化合物是由离子键形成的离子(填“离子”或“共价”)化合物.分析 (1)根据离子化合物电子式的书写规则书写电子式,离子键是阴阳离子之间通过静电作用形成的化学键;
(2)先写出氮化钠和水反应的方程式,再写出氨气和氢氧化钠与盐酸反应的方程式,写出方程式即可;根据方程式判断生成盐的种类;
(3)电子层多半径大,电子层一样的离子,核电荷数越大,半径越小,据此回答.
解答 解:(1)Na3N是钠离子和氮离子之间通过离子键形成的离子化合物,它的电子式为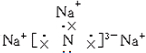 ,
,
故答案为: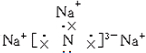 ;离子;离子;
;离子;离子;
(2)Na3N与盐酸反应生成氯化钠和氯化铵,反应的化学方程式为Na3N+4HCl=3NaCl+NH4Cl,故答案为:2;Na3N+4HCl=3NaCl+NH4Cl.
(3)r(Na+)、r(N3-)是电子层一样的离子,核电荷数越大,半径越小,所以r(Na+)<r(N3-),故答案为:<.
点评 本题考查了电子式的书写,先写出氮化钠与水反应的方程式,再根据酸碱中和反应判断最后生成物,能正确判断氮化钠与盐酸反应的生成物是解本题的关键.


 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案科目:高中化学 来源: 题型:多选题
| 实验内容 | 实验目的 | |
| A | 测定同浓度的Na3PO4和Na2SO4水溶液的pH | 探究磷、硫两种元素非金属性的强弱 |
| B | 向蔗糖溶液中加入4滴稀硫酸,煮沸几分钟,冷却,再加入银氨溶液,水溶加热 | 检验蔗糖是否已水解 |
| C | 将乙醇与浓硫酸共热产生气体直接通入酸性kMnO4溶液 | 检验乙烯的生成 |
| D | 向AgCl沉淀中滴加少量KI溶液,观察白色沉淀转化为黄色沉淀 | 验证Ksρ(AgCl)>Ksρ(AgI) |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入H2O(g),平衡向正反应方向移动,体系压强减小 | |
| B. | 加入CO,混合气体的密度增大 | |
| C. | 降低温度,平衡向正反应方向移动 | |
| D. | 加入少量C,正反应速率增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 晶体中阳离子和阴离子数不一定相等 | |
| B. | 晶体中一定只有离子键没有共价键 | |
| C. | 所含元素一定不在同一周期也不在第1周期 | |
| D. | 晶体中阳离子半径一定大于阴离子半径 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
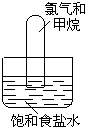 将漫射日光照射到装有氯气和甲烷混合气体(体积比为4:1)的装置上(如图).现列出如下现象,其中正确的是( )
将漫射日光照射到装有氯气和甲烷混合气体(体积比为4:1)的装置上(如图).现列出如下现象,其中正确的是( )| A. | ① | B. | ①④和⑤ | C. | ①和⑤ | D. | ②和⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com