
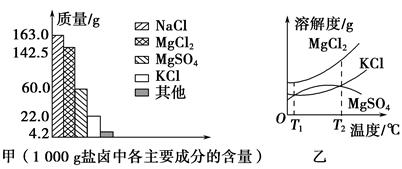
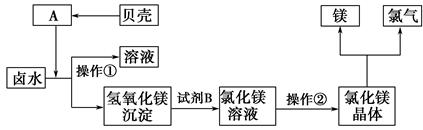
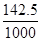 ×
×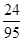 +100 g×
+100 g×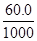 ×
×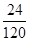 =3.6 g+1.2 g=4.8 g。
=3.6 g+1.2 g=4.8 g。

 寒假学与练系列答案
寒假学与练系列答案科目:高中化学 来源:不详 题型:填空题
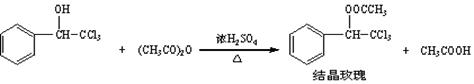
| 三氯甲基苯基甲醇 | 式量:224.5。无色液体。不溶于水,溶于乙醇。 |
| 醋酸酐 | 无色液体。溶于水形成乙酸,溶于乙醇。 |
| 结晶玫瑰 | 式量:267.5。白色至微黄色晶体。熔点:88℃。不溶于水,溶于乙醇,70℃时在乙醇中溶解度为a g。 |
| 醋酸 | 无色的吸湿性液体,易溶于水、乙醇。 |

| 序号 | 实验方案 | 实验现象 | 结论 |
| ① | 将粗产品溶解在 中,按粗产品、溶剂的质量比为1: 混合,用水浴加热到70℃回流溶剂使粗产品充分溶解 | 得到无色溶液 | |
| ② | 将步骤1所得溶液___________ | | |
| ③ | 干燥步骤2所得白色晶体, | __________________ | 白色晶体是结晶玫瑰 |


查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
|
|
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
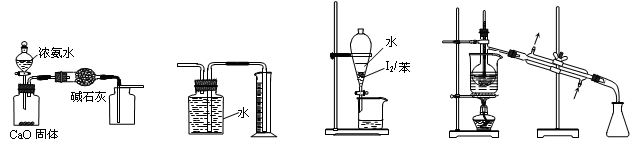
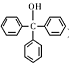 )是一种重要的化工原料和医药中间体,实验室合成三苯甲醇的流程如图1所示,装置如图所示。
)是一种重要的化工原料和医药中间体,实验室合成三苯甲醇的流程如图1所示,装置如图所示。

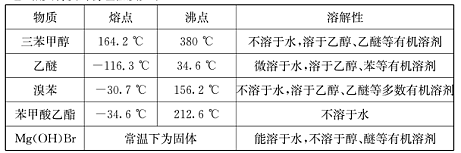
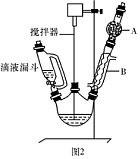

| A.水 | B.乙醚 | C.乙醇 | D.苯 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 华素片(西地碘片)使用说明书 【品名或组成】 品名:西地碘片 组成:华素片 英文名:Cydiodine Tablets 华素片(西地碘片)的主要活性成分是分子碘,含量1.5 mg/片。将碘利用分子分散技术制成分子态西地碘,并含适量薄荷脑等 【贮藏】 遮光、密闭、阴凉处保存 【有效期】 二年 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.加入过量碳酸钠溶液,过滤,除去沉淀,溶液中补加适量硝酸 |
| B.加入过量硫酸钾溶液,过滤,除去沉淀,溶液中补加适量硝酸 |
| C.加入过量硫酸钠溶液,过滤,除去沉淀,溶液中补加适量硝酸 |
| D.加入过量碳酸钾溶液,过滤,除去沉淀,溶液中补加适量硝酸 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
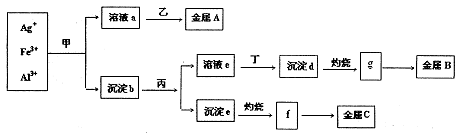
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
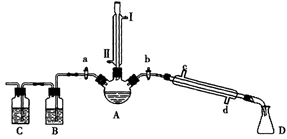
| 物质 | 熔点/℃ | 沸点/℃ |
| 1-丁醇 | -89.5 | 117.3 |
| 1-溴丁烷 | -112.4 | 101.6 |
| 丁醚 | -95.3 | 142.4 |
| 1-丁烯 | -185.3 | -6.5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com