
| 反应 | △H(kJ•mol-1) | 平衡常数K |
| ①4NH3(g)+5O2(g)?4NO(g)+6H2O(g) | -907 | 1.1×1026 |
| ②4NH3(g)+4O2(g)?2N2O(g)+6H2O(g) | -1105 | 4.4×1028 |
| ③4NH3(g)+3O2(g)?2N2 (g)+6H2O(g) | -1269 | 7.1×1034 |
| A. | N2(g)+O2(g)=2NO(g)△H=362 kJ•mol-1 | |
| B. | 增大压强,则反应②的K 不变,反应①和③的K 减小 | |
| C. | 500℃,2N2O(g)+O2(g)═4 NO(g) K=400 | |
| D. | 使用合适的催化剂可提高反应的选择性,提高NO 的产出率 |
分析 A、由盖斯定律可知(①-③)÷2得,反应N2 (g)+O2 (g)=2NO(g)△H═+181 kJ•mol-1;
B、K是关于温度的函数;
C、根据盖斯定律①-②得2N2O(g)+O2(g)═4 NO(g),再列出K;
D、使用合适的催化剂可提高反应的选择性,提高NO的产出率.
解答 解:已知①4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H1=-907kJ•mol-1,k1=1.1×1026
②4NH3(g)+4O2(g)?2N2O(g)+6H2O(g)△H2=-1105kJ•mol-1,k2=4.4×1028
③4NH3(g)+3O2(g)?2N2 (g)+6H2O(g)△H3=-1269kJ•mol-1,k3=7.1×1034
A、由盖斯定律可知(①-③)÷2得,反应N2 (g)+O2 (g)=2NO(g)△H=$\frac{-907-(-1269)}{2}$kJ•mol-1=+181 kJ•mol-1,故A错误;
B、K是关于温度的函数,温度不变,k不变,故B错误;
C、根据盖斯定律①-②得2N2O(g)+O2(g)═4 NO(g),K=$\frac{{k}_{1}}{{k}_{2}}$=$\frac{1.1×1{0}^{26}}{4.4×1{0}^{28}}$=2.5×10-3,故C错误;
D、使用合适的催化剂可提高反应的选择性,提高NO的产出率,故D正确;
故选:D.
点评 本题考查了化学平衡常数的影响因素和盖斯定律书写热化学方程式,为高频考点,侧重于学生的分析能力和计算能力的考查,题目难度中等,注意盖斯定律的应用.


科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有AgBr沉淀生成 | B. | AgCl沉淀多于AgBr沉淀 | ||
| C. | AgCl沉淀少于AgBr沉淀 | D. | AgCl和AgBr沉淀等量生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
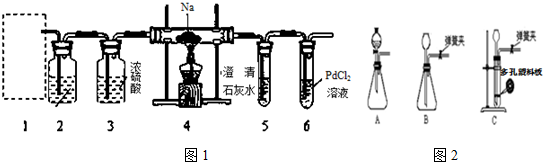
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 700℃ | 900℃ | |
| K1 | 1.47 | 2.15 |
| K2 | 2.38 | 1.67 |
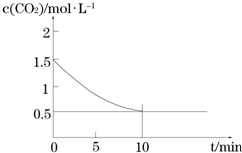
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
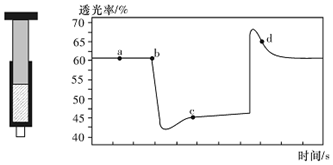
| A. | b点的操作是拉伸注射器 | |
| B. | d点:v(正)>v(逆) | |
| C. | c点与a点相比,c(N02)增大,c(N204)减小,若容器绝热则平衡常数Ka>Kc | |
| D. | 若不忽略体系温度变化,且没有能量损失,则T(b)<T(c) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸氢铵溶液加足量氢氧化钠并加热:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$H2O+NH3↑ | |
| B. | Na218O2加入H2O中:2Na218O2+2H2O═4Na++4OH-+18O2↑ | |
| C. | 硫酸镁溶液加氨水:Mg2++2NH3•H2O═Mg(OH)2↓+2NH4+ | |
| D. | 氧化亚铁溶于稀硝酸:FeO+2H+═Fe2++H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.2 mol中子 | B. | 0.4 mol电子 | C. | 0.2 mol质子 | D. | 0.4 mol分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | ①③ | D. | ①②③ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com