
| A、Cl | B、P | C、Na | D、Ar |
科目:高中化学 来源: 题型:
| A、治理“地沟油”,可通过水解反应制得肥皂 |
| B、“雾霾天气”、“温室效应”、“光化学烟雾”的形成都与氮氧化物无关 |
| C、变质的植物油有难闻的气味,是因为植物油发生了水解反应 |
| D、绿色化学的核心是对环境污染进行治理 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1mol 甲基所含电子数为10NA |
| B、0.1mol的白磷(P4)或甲烷中所含的共价键数均为0.4NA |
| C、在精炼铜或电镀铜的过程中,当阴极析出铜32g转移电子数均为NA |
| D、标准状况下,2.24L 辛烷完全燃烧,生成CO2分子数为8NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、本饮料不含任何化学物质 |
| B、饮用水越纯越好,本蒸馏水绝对纯净,不含任何离子 |
| C、本口服液含丰富的氮、磷、锌等微量元素 |
| D、没有水就没有生命 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、对于N2(g)+3H2(g)?2NH3(g),缩小体积使压强增大 |
| B、对于N2(g)+3H2(g)?2NH3(g),容器体积固定不变时,充入Ar |
| C、对于N2(g)+3H2(g)?2NH3(g),容器体积固定不变时,充入N2 |
| D、对于N2(g)+3H2(g)?2NH3(g),容器气体压强不变时,充入Ar |
查看答案和解析>>
科目:高中化学 来源: 题型:


 (R可表示烃基或氢原子)
(R可表示烃基或氢原子) 的合理线路(其他无机试剂任选,用流程图表示:写出反应物、产物及主要反应条件).
的合理线路(其他无机试剂任选,用流程图表示:写出反应物、产物及主要反应条件).| Cl2 |
| 光照 |
| NaOH溶液 |
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
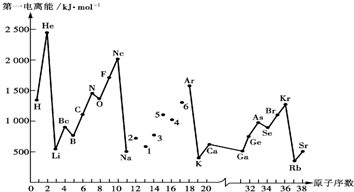
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com