
分析 (1)计算混合后溶液的质量,混合后溶质的质量等于原不同浓度溶液中硫酸的质量之和,结合m(溶质)=m(溶液)×ω(溶质)计算混合后硫酸质量分数;
(2)根据c=$\frac{1000ρω}{M}$计算混合后硫酸的物质的量浓度.
解答 解:(1)将质量相等质量分数分别为16%与24%的两硫酸溶液混合,令混合前质量为m,混合后硫酸的质量分数为ω,则:2m×ω=16%m+24%m,解得ω=20%,
答:混合后溶液的质量分数为20%;
(2)混合后溶液的密度为1.2g/mL,硫酸的质量分数为20%,则c(硫酸)=$\frac{1000×1.2×20%}{98}$mol/L=2.45mol/L,
答:混合溶液中硫酸的物质的量浓度2.45mol/L.
点评 本题考查物质的量浓度有关计算,难度不大,注意理解掌握物质的量浓度与质量分数之间关系,侧重于考查学生的分析能力和计算能力.


科目:高中化学 来源: 题型:解答题
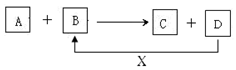 A、B、C、D、X均为中学化学常见的物质.它们之间存在如图所示转化关系.(图中反应条件略去)填写下列空白.
A、B、C、D、X均为中学化学常见的物质.它们之间存在如图所示转化关系.(图中反应条件略去)填写下列空白.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中子数为18的硫原子:${\;}_{16}^{34}S$ | B. | 次氯酸的结构式:H-Cl-O | ||
| C. | H2O2的电子式: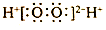 | D. | 乙烯的结构简式:CH2CH2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2SO3溶液和NaHCO3溶液反应:H2SO3+2HCO3-=SO32-+2CO2↑+2H2O | |
| B. | 控制pH为9~10,用NaClO溶液将含NaCN的废水中的CN-氧化为两种无污染的气体:2CN-+5ClO-+2H+=N2↑+2CO2↑+5Cl-+H2O | |
| C. | 已知硫酸铅难溶于水,也难溶于硝酸,却可溶于醋酸铵溶液中,形成无色溶液.当Pb(CH3COO)2溶液中通入H2S气体时有黑色沉淀生成:Pb2++H2S=PbS↓+2H+ | |
| D. | CuSO4溶液与过量浓氨水反应:Cu2++4NH3•H2O=[Cu(NH3)4]2++4H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
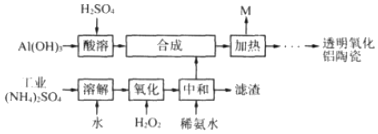
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加水稀释到原体积的10倍,溶液的pH=4 | |
| B. | 加水稀释,溶液中$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)•c(O{H}^{-})}$不变,n(OH-)增大 | |
| C. | 加入10 mL pH=11的NaOH溶液,所得混合液的pH=7 | |
| D. | 加入少量醋酸钠固体,则平衡CH3COOH?CH3COO-+H+逆向移动,K变小 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com