
在等温等压条件下,可逆反应2A(g)+B(g)3C(g)+D(g)起始物质的量如下表所示:
| 序号 | A | B | C | D |
| ① | 2 mol | 1 mol | 0 | 0 |
| ② | 4 mol | 2 mol | 0 | 0 |
| ③ | 1 mol | 0.5 mol | 1.5 mol | 0.5 mol |
| ④ | 0 | 1 mol | 3 mol | 1 mol |
| ⑤ | 0 | 0 | 3 mol | 1 mol |
上述反应达到平衡后,互为等效平衡的是哪几组?达到平衡后,哪些量相同?
 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案科目:高中化学 来源: 题型:
已知亚硫酸钠在空气中能被氧气氧化生成硫酸盐。
Ⅰ.甲同学设计两种方案来检验Na2SO3溶液是否发生变质。
方案一:取样,加入稀盐酸有气泡生成,认为亚硫酸钠溶液没有变质。
方案二:取样,加入氯化钡溶液有白色沉淀生成,认为亚硫酸钠溶液完全变质。
请你对两方案作出评价:
方案一:________(填“合理”或“不合理”),理由是________________________________。
方案二:________(填“合理”或“不合理”),理由是___________________。
Ⅱ.乙同学探究Na2SO3溶液是否发生变质,设计如下实验测定1.0 mol·L-1 Na2SO3溶液的实际浓度。
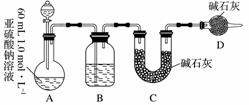
(1)分液漏斗中应加入足量的下列哪种试剂?________(填字母)
a.浓硝酸 b.65%硫酸 c.浓盐酸
(2)实验前后测得C装置增重3.2 g,则Na2SO3溶液实际的物质的量浓度为________。
(3)该实验装置还存在一个明显的缺陷是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
某小组同学设想用如图装置电解硫酸钾溶液来
制取氧气、氢气、硫酸和氢氧化钾。
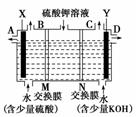
(1)X极与电源的________(填“正”或“负”)极相连,氢气从________(选填“A”、“B”、“C”或“D”)口导出。
(2)离子交换膜只允许一类离子通过,则M为________(填“阴离子”或“阳离子”,下同)交换膜,N为________交换膜。
(3)若将制得的氢气、氧气和氢氧化钾溶液组合为氢氧燃料电池(石墨为电极),则电池负极的电极反应式为________________________________________________________
________________________________________________________________________。
(4)若在标准状况下,制得11.2 L氢气,则生成硫酸的质量是________,转移的电子数为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
某温度下,在密闭容器中SO2、O2、SO3三种气态物质建立化学平衡后,改变条件对反应2SO2(g)+O2(g)2SO3(g),ΔH<0的正、逆反应速率的影响如图所示:
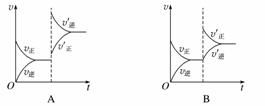
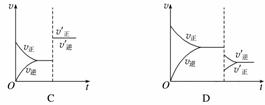
(1)加催化剂对反应速率影响的图像是________(填序号,下同),平衡________移动。
(2)升高温度对反应速率影响的图像是__________,平衡向________方向移动。
(3)增大反应容器体积对反应速率影响的图像是________,平衡向________方向移动。
(4)增大O2的浓度对反应速率影响的图像是__________,平衡向________方向移动。
查看答案和解析>>
科目:高中化学 来源: 题型:
在恒容密闭容器中通入X并发生反应:2X(g)Y(g),温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示。下列叙述正确的是( )
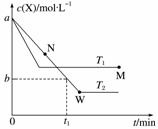
A.该反应进行到M点放出的热量大于进行到W点放出的热量
B.T2下,在0~t1时间内,v(Y)= mol·L-1·min-1
C.M点的正反应速率v正大于N点的逆反应速率v逆
D.M点时再加入一定量X,平衡后X的转化率减小
查看答案和解析>>
科目:高中化学 来源: 题型:
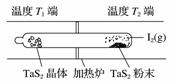
化学反应原理在科研和生产中有广泛应用。利用“化学蒸气转移法”制备TaS2晶体,发生如下反应:TaS2(s)+2I2(g)TaI4(g)+S2(g) ΔH>0(Ⅰ)。如图所示,反应(Ⅰ)在石英真空管中进行,先在温度为T2的一端放入未提纯的TaS2粉末和少量I2(g),一段时间后,在温度为T1的一端得到了纯净TaS2晶体,则温度T1________T2(填“>”、“<”或“=”)。上述反应体系中循环使用的物质是________。
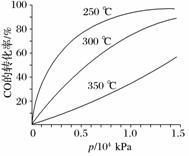
(2)[2011·山东理综,28(3)]CO可用于合成甲醇,反应方程式为CO(g)+2H2(g)CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如下图所示。该反应ΔH______0(填“>”或“<”)。实际生产条件控制在250 ℃、1.3×104 kPa左右,选择此压强的理由是________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
综合下图判断,下列叙述不正确的是
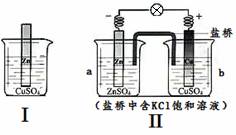
A. Ⅰ、Ⅱ的反应原理均是Zn + Cu2+ = Zn2+ + Cu
B. Ⅰ、Ⅱ中均有电子转移,均是把化学能转化为电能利用
C. 随着反应的进行,Ⅰ、Ⅱ中CuSO4溶液颜色均渐渐变浅
D. 取a中溶液,加足量Ba(NO3)2溶液,过滤后向滤液中加AgNO3溶液,有沉淀产生
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com