
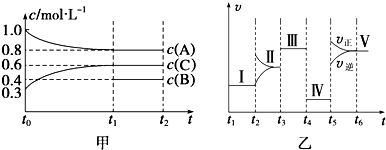
���� ��1������v=$\frac{��c}{��t}$����t0��t1����C���ʵ�Ũ�ȱ仯��ʾ�ķ�Ӧ���ʣ�
��2��t4��t5�����淴Ӧ���ʼ�С����ȣ����ǽ����¶ȣ�ƽ���ƶ������ƶ��������淴Ӧ���ʲ���ȣ������Ǽ�С��ѹǿ������A��CŨ�ȵı仯�ж϶���������ϵ������t4��t5���жϻ�ѧ����ʽ��Ȼ����ݻ�ѧ����ʽ���㣻
��3������t5��t6�����淴Ӧ���ʱ仯��֪��t5ʱ�������¶ȣ�����Ӧ���ʴ����淴Ӧ���ʣ����Ը÷�ӦΪ���ȷ�Ӧ��
��4��Ȼ������������ݼ�����ʱ䣬�������Ȼ�ѧ����ʽ����д����д�����¶��¸÷�Ӧ���Ȼ�ѧ����ʽ��
��5���¶���߷�Ӧ���ʴ���ͼ���֪��������ΪV��
��� �⣺��1����t1=15min��������C��t0��t1ʱ��ε�ƽ����Ӧ����Ϊ��v=$\frac{��c}{��t}$=$\frac{0.6mol/L-0.3mol/L}{15s}$=0.02mol•L-1•min-1���ʴ�Ϊ��0.02mol•L-1•min-1��
��2��t4��t5�θı����������淴Ӧ���ʶ���С����ȣ����Բ������ǽ����¶ȣ�Ӧ��Ϊ��Сѹǿ����Ӧ��A��Ũ�ȱ仯Ϊ��1mol/L-0.8mol/L=0.2mol/L��C��Ũ�ȱ仯Ϊ��0.6mol/L-0.3mol/L=0.3mol/L����Ӧ��A��C�Ļ�ѧ������֮��Ϊ0.2��0.3=2��3������t4��t5�θı�ѹǿƽ�ⲻ�ƶ���֪���÷�Ӧ�ķ���ʽΪ2A��g��+B��g��?3C��g�����ɷ���ʽ��֪��Ӧ���������ĵ�B�����ʵ���Ũ��Ϊ����1mol/L-0.8mol/L����$\frac{1}{2}$=0.1mol/L������B����ʼŨ��Ϊ0.4mol/L+0.1mol/L=0.5mol/L����ij�ܱ������м���4mol A��1.2mol C��һ������B�������壬A����ʼŨ��Ϊ1.0mol/L�����=$\frac{4mol}{1.0mol/L}$=4L�����ʵ���=0.5mol/L��
4L=2mol��
�ʴ�Ϊ����Сѹǿ�� 2mol��
��3���÷�Ӧ���������ķ�Ӧ����t5��t6�����淴Ӧ���ʶ�����˵�����������¶ȣ������¶Ⱥ�����Ӧ���ʴ����淴Ӧ���ʣ�˵���÷�ӦΪ���ȷ�Ӧ���淴ӦΪ���ȷ�Ӧ��
�ʴ�Ϊ�������¶ȣ����ȷ�Ӧ��
��4�����ݣ�2���ļ���õ�A�����ʵ������仯���ʵ���=��1mol/L-0.8mol/L����4L=0.8mol/L�����˹����������������Ƚ�������ΪQkJ������2molA��Ӧ�����仯Ϊ2.5QKJ�����Է�Ӧ���Ȼ�ѧ����ʽΪ��2A��g��+B��g��?3C��g����H=+2.5QKJ/mol��
�ʴ�Ϊ��2A��g��+B��g��?3C��g����H=+2.5QKJ/mol��
��5��ͼ�������֪��Ӧ����Ӱ�����ؿ�֪�������¶ȣ���Ӧ�����������¶���ߣ��ʴ�Ϊ������
���� ���⿼���˻�ѧ��Ӧƽ��Ӱ�����صķ����жϡ��Ȼ�ѧ����ʽ����д���Ѷ��еȣ�����ؼ�����ȷӰ�컯ѧ��Ӧ���ʡ���ѧƽ������أ���3��Ϊ�״��㣬ע�����ͼ���жϸ÷�ӦΪ���ȷ�Ӧ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ������ȩ��+��CH3CO��2O����������$��_{140-170��}^{K_{2}CO_{3}}$
������ȩ��+��CH3CO��2O����������$��_{140-170��}^{K_{2}CO_{3}}$ ������ᣩ+CH3COOH�����ᣩ
������ᣩ+CH3COOH�����ᣩ| ���� | ������ | ��״ | �ܶ�g/cm3 | �۵�� | �е�� | �ܽ�ȣ���/100ml�ܼ� | ||
| ˮ | �� | �� | ||||||
| ����ȩ | 106 | ��ɫҺ�� | 1.06 | -26 | 178-179 | 0.3 | ���� | ���� |
| ������ | 102 | ��ɫҺ�� | 1.082 | -73 | 138-140 | 12 | �� | ���� |
| ����� | 148 | ��ɫ�ᾧ | 1.248 | 133-134 | 300 | 0.04 | 24 | �� |

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

| ʵ����� | ��ʼ�¶�t1/�� | ��ֹ�¶ȣ�t2���� | �²t2-t1���� | ||
| ���� | NaOH��Һ | ƽ��ֵ | |||
| 1 | 25.1 | 24.9 | 25.0 | 31.6 | 6.6 |
| 2 | 25.1 | 25.1 | 25.1 | 31.8 | 6.7 |
| 3 | 25.1 | 25.1 | 25.1 | 31.9 | 6.8 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ����� | ���� | ������ | ����� | ���� | ����� | �ǵ���� |
| ���ڸ�������� | �� | �� | ��� | �� | �ۢݢ� | �٢� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| �������� | Fe��OH��3 | Al��OH��3 | Mg��OH��2 |
| ��ʼ����pH | 2.7 | 3.7 | 9.6 |
| ��ȫ����pH | 3.7 | 4.7 | 11 |
| �¶�/�� | 0 | 10 | 20 | 50 | 75 | 100 |
| Li2CO3���ܽ��/g | 1.539 | 1.406 | 1.329 | 1.181 | 0.866 | 0.728 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����

| A�� | 4��1 | B�� | 1��2 | C�� | 2��1 | D�� | 1��1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
 ��ƿ�����õ��һ��ΪǦ���أ�����һ�ֵ��͵Ŀɳ���أ�����ܷ�ӦʽΪ��2PbSO4+2H2O $?_{�ŵ�}^{���}$Pb+PbO2+4H++2SO42-��������˵����ȷ���ǣ�������
��ƿ�����õ��һ��ΪǦ���أ�����һ�ֵ��͵Ŀɳ���أ�����ܷ�ӦʽΪ��2PbSO4+2H2O $?_{�ŵ�}^{���}$Pb+PbO2+4H++2SO42-��������˵����ȷ���ǣ�������| A�� | �ŵ�ʱ�����ӷ�����B��A | |
| B�� | �ŵ�ʱ��������Ӧ�� Pb-2e-+SO42-�TPbSO4 | |
| C�� | ���ʱ��������Ӧ��PbSO4+2H2O-2e-�TPbO2+SO42-+4H+ | |
| D�� | ���ʱ��Ǧ���صĸ���Ӧ��������Դ���������� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com