
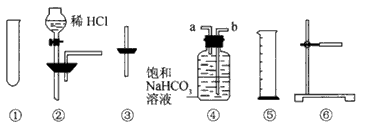
据下图实验,回答问题:

(1)烧瓶中所发生的主要反应的化学方程式为________,装置(Ⅱ)的烧杯中冷水所起的作用是________;装置(Ⅲ)的烧杯中液体的作用是________.
(2)进行此实验时,烧瓶口的橡皮塞最好用锡箔包好,用橡皮管连接的两玻璃管口要相互紧靠,这是因为________________.
(3)装置(Ⅲ)的烧杯中使用倒置漏斗可防止液体倒吸,试简述原因:________.
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
 下表中的数据表示破坏1mol物质中的化学键需消耗的能量(即键能):
下表中的数据表示破坏1mol物质中的化学键需消耗的能量(即键能):| 化学键 | H-H | Cl-Cl | H-Cl |
| 键能/kJ?mol-1 | 436 | 243 | 431 |
查看答案和解析>>
科目:高中化学 来源: 题型:
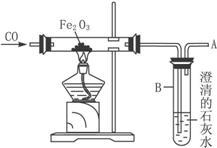
(1)判断硬质玻璃管中已开始发生反应的方法是_____________________________________。
(2)反应过程中发生的现象是____________________。
(3)在A处点燃可见浅蓝色火焰的原因是__________________________________________。
(4)实验结束时应注意的操作是__________________。
①先停止通入CO2 ②先熄灭酒精灯,并继续通入CO ③熄灭酒精灯,同时停止通入CO ④先熄灭酒精灯,继续通入CO,并点燃排出的CO气体
查看答案和解析>>
科目:高中化学 来源:2013-2014学年江西省七校高三上学期第一次联考理综化学试卷(解析版) 题型:填空题
为了探究原电池和电解池的工作原理,某研究性学习小组分别用下图所示的装置进行实验。据图回答问题。

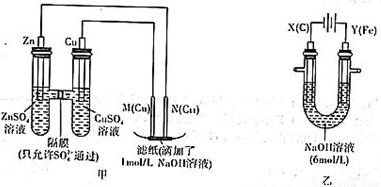
I.用图甲所示装置进行第一组实验时:
(1)在保证电极反应不变的情况下,不能替代Cu作电极的是 (填序号)。
A.石墨 B.镁 C.银 D.铂
(2)实验过程中,SO42− (填“从左向右”“从右向左”或“不”)移动;滤纸上能观察到的现象 。
II.该小组同学用图乙所示装置进行第二组实验时发现,两极均有气体产生,且Y极溶液逐渐变成紫红色:停止实验观察到铁电极明显变细,电解液仍然澄清。查阅资料知,高铁酸根(FeO42-)在溶液中呈紫红色。请根据实验现象及所查信息,回答下列问题:
(3)电解过程中,X极溶液的pH (填“增大”“减小”或“不变”)
(4)电解过程中,Y极发生的电极反应为4OH−-4e−=2H2O+O2↑和 。
(5)电解进行一段时间后,若在X极收集到672mL气体,Y电极(铁电极)质量减小0.28g,则在Y极收集到气体为 mL(均已折算为标准状况时气体体积)。
(6)K2FeO4—Zn也可以组成碱性电池,K2FeO4在电池中作为正极材料,其电池反应为:
2K2FeO4+3Zn=Fe2O3+ZnO+2K2ZnO2,该电池正极发生的电极反应式为 。
查看答案和解析>>
科目:高中化学 来源:同步题 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com