
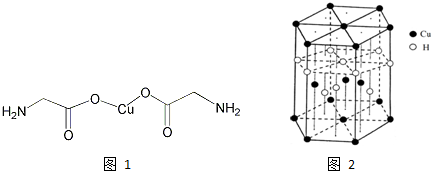
分析 (1)Cu为29号元素,价电子排布为3d104s1;同周期从左到右第一电离能增大,但是第VA和VIA族反常,同主族从上到下第一电离能逐渐减小;
(2)原子数相同、价电子数相同的微粒互为等电子体;
(3)根据碳原子的成键情况要以判断碳原子的杂化方式;
(4)在[Cu(CN)4]2- 中,一个 CN-中含有1个?键,2个π键;
(5)利用均摊法确定其化学式,每个顶点上的原子被6个晶胞占有.
解答 解:(1)铜是29号元素,核外有29个电子,根据构造原理知,其核外电子排布式为:[Ar]3d104s1;同一周期中,元素的第一电离能随着原子序数的增大而增大,但第VA族元素的第一电离能大于其相邻元素,所以N、O元素第一电离能为O<N,同主族从上到下第一电离能逐渐减小,则第一电离能S<O,所以三种元素的第一电离能由小到大的顺序为S<O<N,
故答案为:[Ar]3d104s1;S<O<N;
(2)原子数和价电子数分别相等的两种微粒互为等电子体,PO43-的等电子体有SO42-、ClO4-等,
故答案为:SO42-、ClO4-;
(3)氨基乙酸铜的分子中一种碳有碳氧双键,碳的杂化方式为sp2杂化,另一种碳周围都是单键,碳的杂化方式为sp3杂化,
故答案为:sp3、sp2;
(4)在[Cu(CN)4]2- 中,CN-的结构式为[C≡N]-,三键中含有1个σ键与2个π键,所以1mol[Cu(CN)4]2- 中含有的π键的数目为8NA,故答案为:8NA;
(5)该晶胞中,铜原子个数=3+2×$\frac{1}{2}$+12×$\frac{1}{6}$=6,H原子个数=1+3+6×$\frac{1}{3}$6,所以其化学式为CuH,故答案为:CuH.
点评 本题考查了物质结构及性质,为高考常见题型,涉及电子排布、第一电离能、微粒空间构型的判断、等电子体、杂化理论的应用、晶胞的计算等,侧重考查学生的分析能力和计算能力,注意该题中每个顶点上的原子被6个晶胞占有而不是8个晶胞占有,为易错点,题目难度中等.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 |  |
| A.向100mL 0.1mol•L-1H2SO4溶液中滴加 0.1mol•L-1Ba(OH)2溶液至过量 | B.向100mL 0.1mol•L-1H2SO4溶液中加入NaOH固体 |
 |  |
| C.向一定浓度的氯化钠溶液中加水 | D.向蒸馏水中通入HCl气体 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 大力发展电动车,减少燃油汽车的尾气排放量 | |
| B. | 开发利用各种新能源,减少对化石燃料的依赖 | |
| C. | PM2.5含有的铅、镉、铬、钒、砷等对人体有害的元素均是金属元素 | |
| D. | 多环芳烃是强致癌物,能吸附在PM2.5的表面进入人体 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
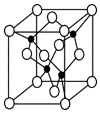 X、Y、Z、U、W 是原子序数依次增大的前四周期元素.其中 Y 的原子核外有 7 种运动状态不同的 电子;X、Z 中未成对电子数均为 2;U 是第三周期元素形成的简单离子中半径最小的元素;W 的内层电 子全充满,最外层只有 1 个电子.请回答下列问题:
X、Y、Z、U、W 是原子序数依次增大的前四周期元素.其中 Y 的原子核外有 7 种运动状态不同的 电子;X、Z 中未成对电子数均为 2;U 是第三周期元素形成的简单离子中半径最小的元素;W 的内层电 子全充满,最外层只有 1 个电子.请回答下列问题: .
.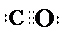 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若混合后溶液中c(H+)>c(OH-),则一定有V1<V2 | |
| B. | 若V1=V2,则二者混合后的溶液中pH>7 | |
| C. | 混合溶液中可能存在:c ( F-)>c (H+)>c (Na+)>c( OH-) | |
| D. | 二者恰好反应完时,则所得溶液中c(F-)=c (Na+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
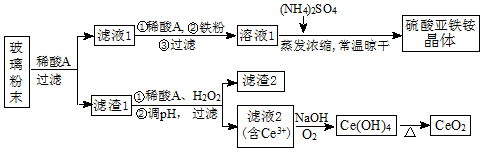
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 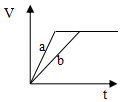 | B. | 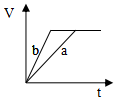 | C. | 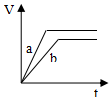 | D. | 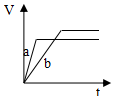 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com