
��9�֣���ԭ���������������4�ֶ�����Ԫ��X��Y��Z��W����֪����X��Z��Y��W�ֱ�ͬ���壻��X��Z��W�ֱ���Y�����γ����ֳ����Ļ������Y����������Z�������Ӻ�������Ų���ͬ���Ը�������������գ�
��1��д����Y��Z�γɵĻ�����Z2Y2�ĵ���ʽ�� ��WY2��X2Y2��Ӧ����ճ����״Һ��Ļ�ѧ����ʽ�� ��
��2�������ֻ����ﶼֻ����������Ԫ�أ�������ˮ��Һ�з�����Ӧ������������ӷ���ʽΪ�� ��
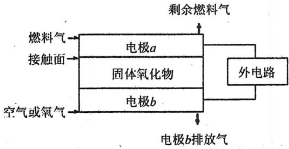
��3��X��Y����Ԫ�صĵ����Ѿ���Ӧ���ڷɴ���ȼ�ϵ���У���ͼ��ʾ�������缫���ɶ����̼���ɣ�ͨ������ֵ����ɿ�϶�ݳ����ڵ缫����ŵ硣

��a��װ�õ� ����
��b���ϵĵ缫��Ӧʽ�� ��
��9�֣�
��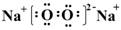 H2O2
+ SO2 = H2SO4
H2O2
+ SO2 = H2SO4
��H+ + HSO3�� = H2O + SO2��
�Ǹ���1���� O2 + 2H2O + 4e�� = 4OH��
��������X��Z��W�ֱ���Y�����γ����ֳ����Ļ������DZ����ƶ�Ԫ�ص���Ҫͻ�Ƶ㣺�����ֳ����Ļ�����ֱ�ΪH2O��H2O2��Na2O��Na2O2����������Ԫ�طֱ�Ϊ��H��O��Na��S��
��3���������������ȼ�յ�أ�����ͨ��������һ��Ϊ������ʧ���ӣ�H2 +2e��+2OH�� = 2H2O��ͨ��������һ��Ϊ�������õ��ӣ�O2 + 2H2O + 4e�� = 4OH����


 �߲������Ӧ��һ��ͨϵ�д�
�߲������Ӧ��һ��ͨϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�


�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�


�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ��ԭ���������������4�ֶ�����Ԫ��X��Y��Z��W����֪��
��ԭ���������������4�ֶ�����Ԫ��X��Y��Z��W����֪��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2010��ӱ�ʡ������ѧ������ѧ�ڵڶ��ο��ԣ����ۣ���ѧ���� ���ͣ������
��14�֣���ԭ�����������������������Ԫ��X��Y��Z��W��R����֪����X��Z��Y��R��W�ֱ�ͬ�壻��X��Z��W�ֱ���Y�������������ѧ�����Ļ������Y����������Z�������ӵĺ�������Ų���ͬ���������������ش����⣺
��1���ҵ��ʿ������뵼����ϣ�д����Ԫ������ �����Ԫ��ԭ��������Ϊ_____
��2���õ���ʽ��ʾ������X2W���γɹ���__________________________________��
��3��д��2�־���X��Y��Z��W 4��Ԫ������ɵĻ�������ˮ��Һ�з�����Ӧ�Ļ�ѧ����ʽ_________________��Z��X��W����Ԫ����ɵ�������ˮ�ʼ��ԣ���Һ������Ũ�ȴ�С˳��Ϊ:______________________________��
��4��X��Y��Ԫ�صĵ����ѱ�Ӧ��������ɴ���ȼ�ϵ�أ���ṹ��ͼ��ʾ�������缫���ɶ����̼���ɣ�ͨ������ֵ����ɿ�϶�ݳ��ڵ缫����ŵ硣b�缫�ϵĵ缫��ӦʽΪ_______��
��5����д��ZԪ�ص��ʵ�һ����;�ߣߣߣߣߣߣߡ�
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com