
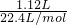 =0.05mol,则:
=0.05mol,则: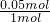 =2.3g
=2.3g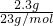 =0.1mol,n(Na2O)=
=0.1mol,n(Na2O)=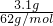 =0.05mol,
=0.05mol,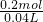 =5mol/L,
=5mol/L, 计算氢气的物质的量,再根据反应2Na+2H2O=2NaOH+H2↑计算样品中Na的质量;
计算氢气的物质的量,再根据反应2Na+2H2O=2NaOH+H2↑计算样品中Na的质量; 计算二者的物质的量,再利用钠元素守恒计算生成NaOH的总物质的量,根据c=
计算二者的物质的量,再利用钠元素守恒计算生成NaOH的总物质的量,根据c= 计算氢氧化钠的浓度.
计算氢氧化钠的浓度.

科目:高中化学 来源:高考三人行 化学 题型:038
将表面已被部分氧化为Na2O的5.4g金属钠放入40mL(4℃)水中,在标准状况下收集到1.12L氢气(ρ=0.0899g/L).试求:
(1)原混合物中钠和氧化钠的质量.
(2)所得NaOH溶液中溶质的质量分数.
查看答案和解析>>
科目:高中化学 来源:物理教研室 题型:038
(1)原混合物中钠和氧化钠的质量。
(2)所得NaOH溶液中溶质的质量分数。
查看答案和解析>>
科目:高中化学 来源: 题型:038
将表面已被部分氧化为Na2O的5.4g金属钠放入40mL(4℃)水中,在标准状况下收集到1.12L氢气(r=0.0899g/L )。试求:
(1)原混合物中钠和氧化钠的质量。
(2)所得NaOH溶液中溶质的质量分数。
查看答案和解析>>
科目:高中化学 来源: 题型:
将表面已被部分氧化为Na2O的5.40 g金属钠放入40.0 mL(4 ℃)水中,在标准状况下收集到1.12 L氢气(ρ=0.089 9 g·L-1)。试求:
(1)原混合物中钠和氧化钠的质量。
(2)所得NaOH溶液中溶质的质量分数。
查看答案和解析>>
科目:高中化学 来源:同步题 题型:单选题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com