
分析 100mL 2mol/L的AlCl3溶液中n(AlCl3)=0.1L×2mol/L=0.2mol,若Al元素都转化为Al(OH)3沉淀,则m[Al(OH)3]=0.2mol×78g/mol=15.6g>7.8g,说明有两种情况:一为沉淀不完全,只生成Al(OH)3沉淀;另一种情况为沉淀部分溶解,既生成Al(OH)3沉淀,又生成NaAlO2,结合方程式计算消耗n(NaOH),进而计算需要V(NaOH).
解答 解:解:100mL 2mol/L的AlCl3溶液中氯化铝的物质的量=0.1L×2mol/L=0.2mol,若Al元素都转化为氢氧化铝沉淀,则氢氧化铝沉淀的质量=0.2mol×78g/mol=15.6g>7.8g,说明有两种情况:一为沉淀不完全,只生成Al(OH)3沉淀;另一种情况为沉淀部分溶解,既生成Al(OH)3沉淀,又生成NaAlO2,
n(Al(OH)3)=$\frac{7.8g}{78g/mol}$=0.1mol,
①若碱不足,由Al3++3OH-═Al(OH)3↓可知,
NaOH的物质的量为0.1mol×3=0.3mol,
加入NaOH溶液的体积为$\frac{0.3mol}{1mol/L}$=0.3L=300mL;
②沉淀部分溶解,既生成Al(OH)3沉淀,又生成NaAlO2,则:
Al3++3OH-═Al(OH)3↓
0.2mol 0.6mol 0.2mol
Al(OH)3+OH-═AlO2-+2H2O
(0.2-0.1)mol (0.2-0.1)mol
则消耗的碱的物质的量为0.6mol+(0.2-0.1)mol=0.7mol,
加入NaOH溶液的体积为$\frac{0.7mol}{1mol/L}$=0.07L=700mL;
答:加入氢氧化钠溶液的体积为300mL或700mL.
点评 本题考查化学方程式计算,为高频考点,侧重考查学生分析计算能力,明确氢氧化铝两性是解本题关键,同时考查学生思维缜密性,为易错题.


 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 1 L 0.1 mol•L-1的CuCl2溶液中含Cu2+为0.1NA | |
| B. | 标准状况下,22.4 L CCl4含CCl4分子为NA | |
| C. | 1mol H3O+含质子数为10 NA | |
| D. | 1mol Na2O2混合物中含阴离子的数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单质的颜色逐渐加深 | B. | 单质的熔沸点逐渐降低 | ||
| C. | 单质的密度逐渐减小 | D. | 单质在水中的溶解度逐渐增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓硝酸保存在棕色玻璃试剂瓶中 | |
| B. | 少量的钠保存在煤油中 | |
| C. | 新制的氯水通常保存在棕色玻璃试剂瓶中 | |
| D. | 氢氧化钠溶液用带磨口玻璃塞的普通试剂瓶贮存 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 大理石溶于醋酸中:CaCO3+2CH3COOH═Ca2++2CH3COO-+CO2↑+H2O | |
| B. | 用硫酸铜溶液吸收硫化氢气体:Cu2++S2-═CuS↓ | |
| C. | 稀硝酸中加入过量铁粉:3Fe+8H++2NO3-═3Fe3++2NO↑+4H2O | |
| D. | 向NaHCO3溶液中加入少量的Ba(OH)2溶液:Ba2++HCO3-+OH-═BaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 苯(甲苯):加酸性高锰酸钾溶液、再加NaOH溶液,分液 | |
| B. | 乙烷(乙烯),催化条件下通入H2 | |
| C. | 乙酸(乙醛),加入新制氢氧化铜,蒸馏 | |
| D. | 乙醛(乙酸),加入氢氧化钠溶液洗涤,蒸馏 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
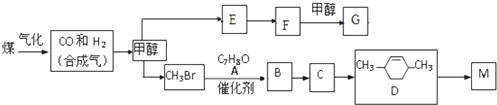
 +RX$\stackrel{催化剂}{→}$
+RX$\stackrel{催化剂}{→}$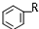 +HX完成下列填空:
+HX完成下列填空: 2HCHO+2H2O.
2HCHO+2H2O.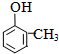 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在蒸发皿中放入NaCl溶液,加热NaCl溶液制取NaCl晶体 | |
| B. | 用100mL的量筒量取5.2mL的盐酸 | |
| C. | 用托盘天平称取25.20gNaCl | |
| D. | 用酒精萃取溴水中的溴单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 制取氨气并完成喷泉实验
制取氨气并完成喷泉实验查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com