
分析 无色可知一定不含Fe3+,由①可知白色沉淀为硫酸钡,则一定含SO42-,
由②可知白色沉淀为AgCl,但①中氯化钡引入氯离子;
由③可知,沉淀部分溶解,沉淀一定为氢氧化镁和氢氧化铝的混合物,且过滤,取滤液加热,无气体放出,则不含NH4+,一定含Al3+、Mg2+,不含CO32-,以此来解答.
解答 解:无色可知一定不含Fe3+,由①可知白色沉淀为硫酸钡,则一定含SO42-,
由②可知白色沉淀为AgCl,但①中氯化钡引入氯离子;
由③可知,沉淀部分溶解,沉淀一定为氢氧化镁和氢氧化铝的混合物,且过滤,取滤液加热,无气体放出,则不含NH4+,一定含Al3+、Mg2+,不含CO32-,
综上所述,待测液中一定存在Al3+、Mg2+、SO42-离子,一定不存在CO32-、NH4+、Fe3+,不能确定的离子是Na+、Cl-;待测液中不确定离子的进一步检验方法为焰色反应检验是否含Na+,取原溶液少许加足量硝酸钡反应后,过滤,取滤液滴加硝酸银观察是否生成沉淀检验Cl-,
故答案为:Al3+、Mg2+、SO42-;CO32-、NH4+、Fe3+;Na+、Cl-;焰色反应检验是否含Na+,取原溶液少许加足量硝酸钡反应后,过滤,取滤液滴加硝酸银观察是否生成沉淀检验Cl-.
点评 本题考查常见离子的检验,为高频考点,把握离子的性质、离子之间的反应和现象为解答的关键,侧重分析与实验能力的考查,注意氯离子的检验为易错点,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 用氯化铁溶液腐蚀铜板:Fe3++Cu=Fe2++Cu2+ | |
| B. | NaHSO4溶液与Ba(OH)2溶液混合至溶液显中性:Ba2++OH-+H++SO42-=BaSO4↓+H2O | |
| C. | 在碳酸氢镁溶液中加入过量氢氧化钠溶液:Mg2++2HCO3-+4OH-=Mg(OH)2↓+2H2O+2CO32- | |
| D. | 向稀醋酸中加入石灰石:CaCO3+2H+=Ca2++CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

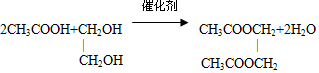 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| NH3•H2O | 2×10-5 |
| HNO2 | 7×10-4 |
| HClO | 3×10-8 |
| H2CO3 | K1=4×10-7 K2=4×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
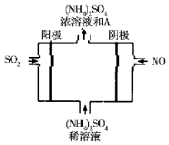 近年来,雾霾天气频繁出现,严重影响人们的生活和健康.其中首要污染物为可吸入颗粒物PM2.5,其主要来源为燃煤、机动车尾气等.因此,对PM2.5,SO2,NOx等进行研究具有重要意义.请回答下列问题:
近年来,雾霾天气频繁出现,严重影响人们的生活和健康.其中首要污染物为可吸入颗粒物PM2.5,其主要来源为燃煤、机动车尾气等.因此,对PM2.5,SO2,NOx等进行研究具有重要意义.请回答下列问题:| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol•L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
| 物质 温度/℃ | 活性炭 | NO | CO2 | N2 |
| 初始 | 3.000 | 0.10 | 0 | 0 |
| T1 | 2.960 | 0.020 | 0.040 | 0.040 |
| T2 | 2.975 | 0.050 | 0.025 | 0.025 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
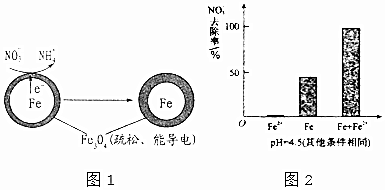
| 初始pH | pH=2.5 | pH=4.5 |
| 1小时pH | 接近中性 | 接近中性 |
| 24小时pHNO3-的去除率 | 接近100% | <50% |
| 铁的最终物质形态 | 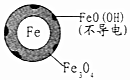 | 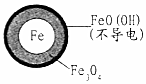 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:r(Z)>r(W)>r(Y)>r(X) | |
| B. | Y的简单气态氢化物的热稳定性比W的强 | |
| C. | Z3W中既含有离子键又含有共价键 | |
| D. | X的单质不能与Y的最高价氧化物对应的水化物反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe3O4溶于足量稀HNO3:Fe3O4+8H+═Fe2++2Fe3++4H2O | |
| B. | NaHSO4溶液与Ba(OH)2溶液混合至中性:H++SO42-+Ba2++OH-═BaSO4↓+H2O | |
| C. | K37ClO3与浓盐酸在加热条件下生成氯气:37ClO3-+6Cl-+6H+═37Cl-+3Cl2↑+3H2O | |
| D. | 4mol•L-1的NaAlO2溶液与7mol•L-1的盐酸等体积互相均匀混合:4AlO2-+7H++H2O═3Al(OH)3↓+Al3+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com