
【题目】氢原子是最轻的原子,人们曾预言它可能是所有元素之母。碳是地球上组成生命的最基本的 元素之一。按要求回答:
(1)宇宙中含量最多的元素是氢和______。基态碳原子的核外电子占有______个原子轨道。
(2)光化学烟雾中除了含有 NOx 外,还含有 HCOOH、![]() (PAN)等二次污染物。
(PAN)等二次污染物。
①PAN 中 C 的杂化方式有______。1mol PAN 中含有的σ键数目为______。组成PAN 的元素的电负性大小顺序为______。
②相同压强下,HCOOH 的沸点比 CH3OCH3______(填“高”或“低”),
(3)水溶液中有 H3O+、H5O2+ 、H9O4 + 等微粒的形式。请画出 H5O2 的结构式:______。
(4)硅和碳在同一主族。下图为 SiO2 晶胞中 Si 原子沿 z 轴方向在 xy 平面的投影图(即俯视图),其 中 O原子略去,Si 原子旁标注的数字表示每个 Si 原子位于 z 轴的高度,则 SiA 与 SiB 之间的距离是______nm。
 (d 的单位为 nm)
(d 的单位为 nm)
【答案】氦 4 sp2 sp3 10NA(或6.02×1024) O>N>C>H 高 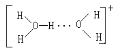
![]()
【解析】
(1)宇宙中氢元素占88.6%、氦占11.1%,宇宙中含量最多的元素是氢和氦;C的电子排布为1s22s22p2,1s和2s轨道上有2个电子,p能级有3个轨道,每个电子优先占据1个轨道,则基态碳原子核外电子占有4个轨道;
(2)①甲基的VSEPR模型为四面体构型,-COO-上C的VSEPR模型为平面三角形结构,则C原子的杂化类型分别为sp2、sp3;一个双键含有一个σ键,由PAN结构可知,一个![]() 中含有10个σ键,所以1molPAN中含有的σ键数目为10NA;PAN分子中含有C、H、N、O元素,元素的非金属性越强,其电负性越大,则电负性:O>N>C>H;
中含有10个σ键,所以1molPAN中含有的σ键数目为10NA;PAN分子中含有C、H、N、O元素,元素的非金属性越强,其电负性越大,则电负性:O>N>C>H;
②由于HCOOH存在分子间氢键,CH3OCH3只存在分子间作用力,所以HCOOH的沸点比CH3OCH3高;
(3)H5O2+是由水分子和H3O+通过氢键形成的微粒,则H5O2+的结构式为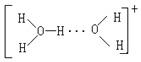 ;
;
(4)根据图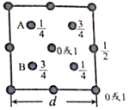 可知其三维模型为
可知其三维模型为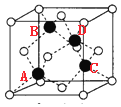 (图中黑球和白球均为硅原子,氧原子位于两个硅原子之间,省略),图中ABCD四个Si原子形成正四面体结构,且AB距离等于AC距离,AC距离在底面投影为底面面对角线的一半,则SiA与SiB的距离=
(图中黑球和白球均为硅原子,氧原子位于两个硅原子之间,省略),图中ABCD四个Si原子形成正四面体结构,且AB距离等于AC距离,AC距离在底面投影为底面面对角线的一半,则SiA与SiB的距离=![]() nm。
nm。


科目:高中化学 来源: 题型:
【题目】某高分子化合物![]() 的结构简式如下:
的结构简式如下:
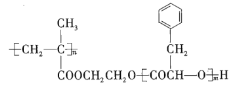
下列有关![]() 的说法正确的是( )
的说法正确的是( )
A.![]() 的一种单体的分子式可能为
的一种单体的分子式可能为![]()
B.![]() 完全水解后的生成物均为小分子有机物
完全水解后的生成物均为小分子有机物
C.可以通过加聚反应和缩聚反应合成![]()
D.碱性条件下,![]() 完全水解消耗NaOH的物质的量为
完全水解消耗NaOH的物质的量为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学用语是学习化学的重要工具,下列化学用语中正确的是( )
A. 氢氧燃料电池在碱性介质中负极的反应式是:O2+2H2O+4e- = 4OH-
B. NaHCO3在水溶液中的水解离子方程式:HCO3-+H2O![]() CO2↑+ OH-
CO2↑+ OH-
C. 用FeS为沉淀剂除去废水中的Hg2+:FeS(s)+ Hg2+(aq)=HgS(s)+Fe2+(aq)
D. 钢铁发生电化学腐蚀的正极反应式:Fe-2 e- = Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为相互串联的甲、乙两电解池,其中甲池为电解精炼铜的装置。
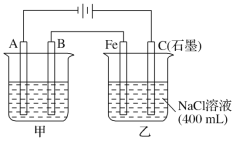
试回答下列问题:
(1)A是________极,材料是________,电极反应为_____________,B是________极,材料是________,主要电极反应为_________________,电解质溶液为________。
(2)乙池中若滴入少量酚酞溶液,电解一段时间后Fe极附近溶液呈________色。
(3)常温下,若甲池中阴极增重12.8 g,则乙池中阳极放出的气体在标准状况下的体积为________。若此时乙池剩余液体为400 mL,则电解后得到碱液的物质的量浓度为________,pH为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有利于可持续发展的生态环境是全国文明城市评选的测评项目之一。
(1)已知反应 2NO(g)+2CO(g)![]() N2(g)+2CO2(g) v 正=k 正·c2(NO)·c2(CO),v 逆=k 逆·c(N2)·c2(CO2)(k正、k逆为速率常数,只与温度有关)。一定条件下进行该反应,测得 CO 的平衡转化率与温度、起始投料比m=
N2(g)+2CO2(g) v 正=k 正·c2(NO)·c2(CO),v 逆=k 逆·c(N2)·c2(CO2)(k正、k逆为速率常数,只与温度有关)。一定条件下进行该反应,测得 CO 的平衡转化率与温度、起始投料比m=![]() 的关系如图 1 所示。
的关系如图 1 所示。

①达到平衡后,仅升高温度,k正增大的倍数________填“>”“<”或“=”)k逆增大的倍数。
②下列说法正确的是_______。
A 投料比:m1<m2<m3
B 汽车排气管中的催化剂可提高 NO 的平衡转化率
C 当投料比 m=2 时,NO 转化率比 CO 转化率小
D 当体系中 CO2 和 CO 物质的量浓度之比保持不变时,反应达到平衡状态
③若在 1L 的密闭容器中充入 1 molCO 和 1 mol NO,在一定温度下达到平衡时,CO 的转化率为 40%, 则 k 正︰k 逆=_______(填写分数即可,不用化简)
(2)在 2L 密闭容器中充入 2mol CO 和 1mol NO2,发生反应 4CO(g)+2NO2(g)![]() N2(g)+4CO2(g) ΔH<0,如图 2 为平衡时 CO2 的体积分数与温度、 压强的关系。
N2(g)+4CO2(g) ΔH<0,如图 2 为平衡时 CO2 的体积分数与温度、 压强的关系。
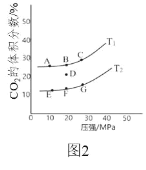
①该反应达到平衡后,为在提高反应速率同时提高 NO 的转化率,可采 取的措施有______(填字母序号)
a 增加 CO 的浓度 b 缩小容器的体积 c 改用高效催化剂 d 升高温度
②若在 D 点对反应容器降温的同时缩小体积至体系压强增大,达到的平衡状态可能是图中 A G 点中的______点。
(3)近年来,地下水中的氮污染已成为一个世界性的环境问题。在金属Pt、Cu和铱(Ir)的催化作用下,密闭容器中的 H2 可高效转化酸性溶液中的硝态氮(NO3-),其工作原理如下图所示。若导电基体上的 Pt 颗粒增多,造成的后果是______。
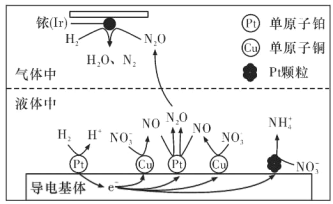
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.水的电离平衡线如图所示.若以A点表示25℃时水在电离平衡时的离子浓度,当温度上升到100℃时,水的电离平衡状态到B点

(1)在100℃时,Kw表达式为_______,在此温度下,kw为___.
(2)在室温下,将pH=9的Ba(OH)2溶液与pH=5的稀盐酸混合,欲使混合溶液pH=7则Ba(OH)2与盐酸的体积比为____.
(3)室温时将PH为3的硫酸溶液稀释100倍,稀释后溶液中,C(SO42-)和C(H+)之比约为___.
II.今有①CH3COOH ②HCl ③H2SO4三种溶液.根据要求回答下列问题:
(1)写出①的电离方程式_______.
(2)当它们pH相同时,其物质的量浓度最大的是___(填序号).
(3)当它们的物质的量浓度相同时,其pH最小是___(填序号).
(4)在室温下,将c(H+)均为0.01mol/L的三种酸分别加水稀释至原来的10倍,c(H+)由大到小的顺序为___(填序号).
(5)体积和物质的量浓度均相同的①②③三种酸溶液,分别与相同浓度的烧碱溶液恰好完全反应,所需烧碱的体积比为____.
(6)三酸的pH相同时,若耗等量的Zn,则需三酸的体积大小关系为___(填序号).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酰氯(NOCl)是有机物合成中的重要试剂,为红褐色液体或黄色气体,室温下为不稳定的黄色气体, 具刺鼻恶臭味,遇水分解,某学习小组用 C12 和 NO 制备 NOCl 装置如图。下列说法错误的是
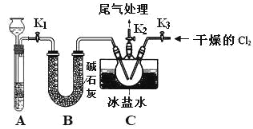
A.氯气在反应中做氧化剂
B.装入药品后,要先打开 K2、K3,反应一段时间后,再打开 K1
C.利用 A 装置还可以做 Na2O2 和水制氧气的实验
D.若没有 B 装置,C 中可能发生反应:2NOCl+H2O=2HCl+NO↑+NO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车的启动电源常用铅蓄电池。其结构如图所示,放电时的电池反应为PbO2+Pb+2H2SO4=2PbSO4+2H2O。根据此反应判断下列说法正确的是( )
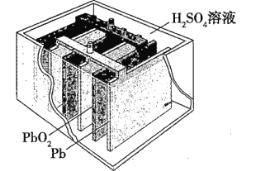
A.PbO2是电池的负极
B.Pb是电池的负极
C.PbO2得电子,被氧化
D.电池放电时,溶液的酸性增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环己烯是重要的化工原料。其实验室制备流程如下:
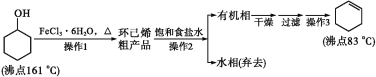
回答下列问题:
Ⅰ.环己烯的制备与提纯
(1)原料环己醇中若含苯酚杂质,检验试剂为__________,现象为____________。
(2)操作1的装置如图所示(加热和夹持装置已略去)。
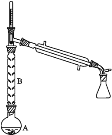
①烧瓶A中进行的可逆反应化学方程式为__________________________________,浓硫酸也可作该反应的催化剂,选择FeCl3·6H2O而不用浓硫酸的原因为___________(填序号)。
a.浓硫酸易使原料炭化并产生SO2
b.FeCl3·6H2O污染小、可循环使用,符合绿色化学理念
c.同等条件下,用FeCl3·6H2O比浓硫酸的平衡转化率高
②仪器B的作用为____________________________。
(3)操作2用到的玻璃仪器是__________________________。
Ⅱ.环己烯含量的测定
在一定条件下,向a g环己烯样品中加入定量制得的b mol Br2,与环己烯充分反应后,剩余的Br2与足量KI作用生成I2,用c mol·L-1的Na2S2O3标准溶液滴定,终点时消耗Na2S2O3标准溶液V mL(以上数据均已扣除干扰因素)。
测定过程中,发生的反应如下:
①Br2+![]() →
→![]()
②Br2+2KI=I2+2KBr
③I2+2Na2S2O3=2NaI+Na2S4O6
(4)滴定所用指示剂为__________________________。样品中环己烯的质量分数为______________________(用字母表示)。
(5)下列情况会导致测定结果偏低的是__________________(填序号)。
a.样品中含有苯酚杂质
b.在测定过程中部分环己烯挥发
c.Na2S2O3标准溶液部分被氧化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com