
| Fe3+ | Co2+ | Co3+ | Al3+ | |
| pH(开始沉淀) | 1.9 | 7.15 | -0.23 | 3.4 |
| pH(完全沉淀) | 3.2 | 9.15 | 1.09 | 4.7 |
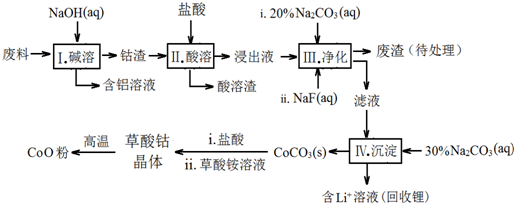
分析 该工艺流程为:废料加入氢氧化钠溶液碱浸,得到钴渣,加入盐酸溶解后发生氧化还原反应,氧化钴氧化氯离子为氯气,过滤得到酸溶的溶液加入碳酸钠溶液和NaF溶液净化,除去锂离子和铁离子,在滤液中加入碳酸钠溶液沉淀钴离子为碳酸钴沉淀,加入盐酸和草酸铵溶液得到草酸钴晶体,高温分解得到氧化钴;
(1)步骤Ⅰ中铝与氢氧化钠反应生成偏铝酸钠和氢气;
(2)Co2O3与盐酸反应生成Cl2,依据得失电子守恒结合原子个数守恒写成反应的离子方程式;
(3)依据表中数据分析判断加入碳酸钠调节溶液PH,沉淀铁离子和锂离子,但不能沉淀钴离子;
(4)NaF与溶液中的Li+形成LiF沉淀,防止锂离子结合碳酸根离子形成碳酸锂沉淀;
(5)210℃~290℃过程中是CoC2O4发生的反应,210℃~290℃过程中产生的气体只有CO2 ,依据元素守恒得到生成CO2物质的量为0.06mol,质量=0.06mol×44g/mol=2.64g,气体质量共计减小=4.41g-2.41g=2g,说明不是分解反应,参加反应的还有氧气,则反应的氧气质量=2.64g-2g=0.64g,O2物质的量=$\frac{0.064g}{32g/mol}$=0.02mol,依据原子守恒配平书写反应的化学方程式;
(6)LiCoO2中锂元素化合价为+1价,则依据放电反应分析判断,LixC中锂元素化合价为0价,由锂离子电池的总反方程式可知C+LiCoO2→LixC+Li1-xCoO2为充电过程即为电解池,则锂硫电池给锂离子电池充电,LiCoO2为阳极失电子发生氧化反应.
解答 解:(1)步骤Ⅰ中铝与氢氧化钠反应生成偏铝酸钠和氢气,反应的离子方程式:2Al+2OH-+2H2O=2AlO2-+3H2↑;
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(2)Co2O3与盐酸反应生成Cl2,反应中钴元素化合价降低为+2价.氯元素化合价-1价变化为0价,依据得失电子守恒可知Co2O3的系数为1,Cl-的系数为2,结合原子个数守恒,反应的离子方程式:Co2O3+6H++2Cl-=2Co2++Cl2↑+3H2O;
故答案为:Co2O3+6H++2Cl-=2Co2++Cl2↑+3H2O;
(3)依据表中数据分析判断加入碳酸钠调节溶液PH,沉淀铁离子和锂离子,但不能沉淀钴离子,步骤Ⅲ中Na2CO3溶液的作用是调节溶液的pH,应使溶液的pH不超过7.15,废渣中的主要成分为LiF和Fe(OH)3;
故答案为:7.15; LiF,Fe(OH)3;
(4)NaF与溶液中的Li+形成LiF沉淀,此反应对步骤Ⅳ所起的作用是,降低溶液中Li+浓度,避免步骤Ⅳ中产生Li2CO3沉淀;
故答案为:降低溶液中Li+浓度,避免步骤Ⅳ中产生Li2CO3沉淀;
(5)210℃~290℃过程中是CoC2O4发生的反应,产生的气体只有CO2 ,依据元素守恒得到生成CO2物质的量为0.06mol,质量=0.06mol×44g/mol=2.64g,气体质量共计减小=4.41g-2.41g=2g,说明说明有气体参加反应应为氧气,则反应的氧气质量=2.64g-2g=0.64g,O2物质的量=$\frac{0.064g}{32g/mol}$=0.02mol,则:
n(CoC2O4):n(O2):n(CO2)=0.03:0.02:0.06=3:2:6,
方程式计量系数之比等于转化量之比,所以该反应的方程式为:3CoC2O4+2O2$\frac{\underline{\;210-290℃\;}}{\;}$Co3O4+6CO2;
故答案为:3CoC2O4+2O2$\frac{\underline{\;210-290℃\;}}{\;}$Co3O4+6CO2;
(6)LiCoO2中锂元素化合价为+1价,则依据放电为原电池反应,锂元素化合价升高发生氧化反应分析判断,LixC中锂元素化合价为0价,是锂单质镶嵌在碳中做原电池负极,由锂离子电池的总反方程式可知C+LiCoO2→LixC+Li1-xCoO2为充电过程即为电解池,则锂硫电池给锂离子电池充电,LiCoO2为阳极失电子发生氧化反应:LiCoO2-xe-=Li1-xCoO2 +xLi+,C为阴极得电子发生还原反应:C+xe-+xLi+=LixC,
故答案为:0;LiCoO2-xe-=Li1-xCoO2+xLi+.
点评 本题通过从某工业废料中回收钴的工艺流程考查了化学方程式、离子方程式书写,确各个阶段固体成分及先后分解生成物成分是解本题关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | (10-8+10-10)mol/L | B. | (10-4+10-6)mol/L | C. | (10-8+10-9)mol/L | D. | 2×10-10mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
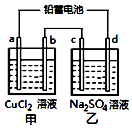 用铅蓄电池电解甲、乙电解池中的溶液.已知铅蓄电池的总反应为:Pb+PbO2+2H2SO4$?_{充电}^{放电}$2PbSO4+2H2O电解一段时间后向c极和d极附近分别滴加酚酞试剂,c极附近溶液变红,下列说法正确的是( )
用铅蓄电池电解甲、乙电解池中的溶液.已知铅蓄电池的总反应为:Pb+PbO2+2H2SO4$?_{充电}^{放电}$2PbSO4+2H2O电解一段时间后向c极和d极附近分别滴加酚酞试剂,c极附近溶液变红,下列说法正确的是( )| A. | d极为阴极 | |
| B. | 放电时铅蓄电池负极的电极反应式为:PbO2+4H++SO42-+4e-=PbSO4+2H2O | |
| C. | 若四个电极材料均为石墨,当析出6.4gCu时,消耗H2SO40.2mol | |
| D. | 甲池中阳离子向b极移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 13C与14C | B. | CH3CH2OH与CH3COOH | ||
| C. | 甲烷与丙烷 | D. | CH3CH2CH2CH3与CH3CH2CH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 x/m,该反应可用来检验Cr2O72-的存在.写出反应的离子方程式Cr2O72-+4H2O2+2H+=2CrO5+5H2O.
x/m,该反应可用来检验Cr2O72-的存在.写出反应的离子方程式Cr2O72-+4H2O2+2H+=2CrO5+5H2O.查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等质量的硫蒸气和硫黄固体分别完全燃烧,前者放出的热量多 | |
| B. | a℃、b kPa下,将0.5 mol O2和1.5 mol H2置于密闭容器中充分反应生成H2O(g),放热c kJ,其热化学方程式为2H2(g)+O2(g)=2H2O(g)△H=-2c kJ•mol-1 | |
| C. | 由N2O 4(g)?2NO2(g)△H=-56.9 kJ•mol-1,可知将1mol N2O4(g)置于密闭容器中充分反应后放出热量为56.9kJ | |
| D. | 稀硫酸溶液与稀NaOH溶液反应的中和热为57.3 kJ•mol-1,则稀醋酸溶液与稀NaOH溶液反应的热化学方程式可表示为CH3COOH(aq)+NaOH(aq)=CH3COONa(aq)+H2O(l)△H=-57.3 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol HCl所具有的总能量高于1 mol H2所具有的总能量 | |
| B. | 1 mol H2和1 mol Cl2所具有的总能量高于2 mol HCl所具有的总能量 | |
| C. | 断开1 mol H-H键和1 mol Cl-Cl键所吸收的总能量大于形成1mol H-Cl键所放出的能量 | |
| D. | 该反应中,化学能只转变为热能 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com