
下列各组原子中,彼此的化学性质一定相似的是( )
A.P原子:1s2;Q原子:2s2
B.P原子:M能层上有2个电子;Q原子:N能层上有2个电子
C.P原子:2p能级上有1个未成对电子;Q原子:3p能级上也有1个未成对电子
D.P原子:最外层L能层上只有一个空轨道;Q原子:最外层M能层上也只有一个空轨道
 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
活力试卷系列答案科目:高中化学 来源:2014高考化学苏教版总复习 专题2从海水中获得的化学物质练习卷(解析版) 题型:实验题
实验室测定含碘废液中I-的含量以及碘的回收过程如下:
Ⅰ.含碘废液中I-含量的测定
用移液管量取25.00 mL废液于250 mL锥形瓶中,分别加入5 mL 2 mol·L-1 H2SO4和10 mL 20% NH4Fe(SO4)2·12H2O溶液,摇匀。小火加热蒸发至碘完全升华,取下锥形瓶冷却后,加入10 mL 2 mol·L-1H2SO4,加入几滴二苯胺磺酸钠(用作指示剂),用0.0250 mol·L-1标准K2Cr2O7溶液进行滴定至终点。重复3次,数据记录如下表:
(已知反应:①2Fe3++2I-=2Fe2++I2 ②6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O)
次数 | 1 | 2 | 3 |
滴定体积(mL) | 19.60 | 19.65 | 19.55 |
Ⅱ.碘的回收
取250 mL含碘废液于烧杯中加入按上述计算所需的Na2S2O3溶液,并将CuSO4饱和溶液在不断搅拌下滴加到废液中,加热至70℃左右完全反应(已知:2I-+2Cu2++2S2O32-=2CuI↓+S4O62-)。过滤,得到的沉淀按图1进行操作。检查装置的气密性后,从分液漏斗中逐滴加入浓硝酸(注意滴液的速度)完全反应后,通过减压过滤,得到粗碘固体产品和抽滤液。然后按图2进行粗碘的提纯。
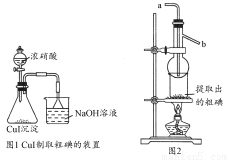
回答下列问题:
(1)用移液管量取废液时,将移液管竖直放入稍倾斜的锥形瓶中,接着的操作是______________________________________,数秒后,取出移液管。
(2)在盛有废液的锥形瓶中先加入5 mL 2 mol·L-1 H2SO4的目的是__________________________。
(3)根据滴定有关数据,该废液中I-含量是________g·L-1。
在滴定过程中,下列操作(其他操作正确)会造成测定结果偏低的是_____。
A.终点读数时俯视读数,滴定前平视读数
B.锥形瓶水洗后未干燥
C.滴定管未用标准K2Cr2O7溶液润洗
D.盛标准K2Cr2O7溶液的滴定管,滴定前有气泡,滴定后无气泡
(4)在图1锥形瓶中发生反应的化学方程式是____________________。
(5)按图2装置进行粗碘提纯,采用的分离方法是________,a、b为冷凝水进出口,其中________(选填a或b)接水龙头进水。最终得到较高纯度的单质碘。
查看答案和解析>>
科目:高中化学 来源:2014高考化学苏教版总复习 专题13化学与技术练习卷(解析版) 题型:填空题
由黄铜矿(主要成分是CuFeS2)炼制精铜的工艺流程示意图如下:

(1)在反射炉中,把铜精矿砂和石英砂混合加热到1000℃左右,黄铜矿与空气反应生成Cu和Fe的低价硫化物,且部分Fe的硫化物转变为低价氧化物。该过程中两个主要反应的化学方程式分别是________________、________________,反射炉内生成炉渣的主要成分是________;
(2)冰铜(Cu2S和FeS互相熔合而成)含Cu量为20%~50%。转炉中,将冰铜加熔剂(石英砂)在1200℃左右吹入空气进行吹炼。冰铜中的Cu2S被氧化为Cu2O,生成的Cu2O与Cu2S反应,生成含Cu量约为98.5%的粗铜,该过程发生反应的化学方程式分别是________________、________________;
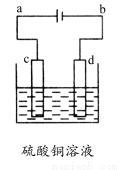
(3)粗铜的电解精炼如图所示。在粗铜的电解过程中,粗铜板应是图中电极________(填图中的字母);在电极d上发生的电极反应式为________________;若粗铜中还含有Au、Ag、Fe,它们在电解槽中的存在形式和位置为________。
查看答案和解析>>
科目:高中化学 来源:2014高考化学苏教版总复习 专题13化学与技术练习卷(解析版) 题型:选择题
下列叙述正确的是( )
A.“接触法”制H2SO4时,催化氧化阶段的反应原理为2SO2(g)+O2(g)  2SO3(g) ΔH<0
2SO3(g) ΔH<0
B.海水提镁的主要步骤为
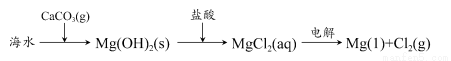
C.普通水泥的主要成分是硅酸钙
D.黏土的主要成分是三氧化二铝
查看答案和解析>>
科目:高中化学 来源:2014高考化学苏教版总复习 专题12物质结构与性质练习卷(解析版) 题型:填空题
氧元素与多种元素具有亲和力,所形成化合物的种类很多。
(1)氮、氧、氟元素的第一电离能从大到小的顺序为________。氧元素与氟元素能形成OF2分子,该分子的空间构型为________。
(2)根据等电子原理,在NO2+离子中氮原子轨道杂化类型是________;1 mol O22+中含有的π键数目为________个。
(3)氧元素和过渡元素可形成多种价态的金属氧化物,如和铬可生成Cr2O3、CrO3、CrO5等。Cr3+基态核外电子排布式为________。
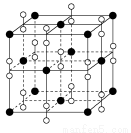
(4)钙在氧气中燃烧时得到一种钙的氧化物晶体,其晶体结构如图所示,则该钙的氧化物的化学式为________。
(5)下列物质的分子与O3分子的结构最相似的是________。
A.H2O B.CO2 C.SO2 D.BeCl2
(6)O3分子是否为极性分子?________。
查看答案和解析>>
科目:高中化学 来源:2014高考化学苏教版总复习 专题12物质结构与性质练习卷(解析版) 题型:选择题
下列描述中正确的是( )
A.CS2为V形的极性分子
B.ClO3—的空间构型为平面三角形
C.SF6中有6对完全相同的成键电子对
D.SiF4的中心原子为sp3杂化,SO32—的中心原子为sp2杂化
查看答案和解析>>
科目:高中化学 来源:2014高考化学苏教版总复习 专题12物质结构与性质练习卷(解析版) 题型:选择题
下列说法中正确的是( )
A.第三周期所包含的元素中钠的原子半径最小
B.钠的第一电离能比镁的第一电离能大
C.在所有元素中,氟的电负性最大
D.电子云示意图中的每个小黑点都表示一个电子
查看答案和解析>>
科目:高中化学 来源:2014高考化学苏教版总复习 专题11有机化学基础练习卷(解析版) 题型:选择题
某有机物M的结构简式如下图,下列叙述错误的是 ( )

A.M的分子式为C11H8O5
B.M能发生银镜反应
C.M能使FeCl3溶液显色
D.1 mol M与足量NaOH溶液反应时,最多消耗3 mol NaOH
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师高考模拟演练练习卷(A)(解析版) 题型:实验题
现要测定某氯化亚铁和氯化铁混合物中铁元素的质量分数,按以下步骤进行实验:
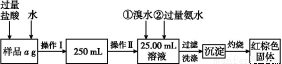
Ⅰ.请根据上面流程,回答以下问题:
(1)操作Ⅰ所用到的玻璃仪器除烧杯、玻璃棒外,还必须有 、 (填仪器名称)。
(2)请写出加入溴水发生的离子反应方程式: 。
(3)将沉淀物加热,冷却至室温,用天平称量其质量为b1 g,再次加热并冷却至室温称量其质量为b2 g,若b1-b2=0.3 g,则接下来还应进行的操作是 。
若蒸发皿质量是W1 g,蒸发皿与加热后固体总质量是W2 g,则样品中铁元素的质量分数是 。
Ⅱ.有同学提出,还可以采用以下方法来测定:
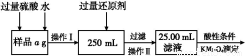
(1)溶解样品改用了硫酸,而不再用盐酸,为什么? 。
(2)选择的还原剂是否能用铁 (填“是”或“否”),原因是: 。
(3)若滴定用掉c mol/L KMnO4溶液b mL,则样品中铁元素的质量分数是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com