
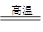 2Cu + SO2
2Cu + SO2 FeSO4 + Cu
FeSO4 + Cu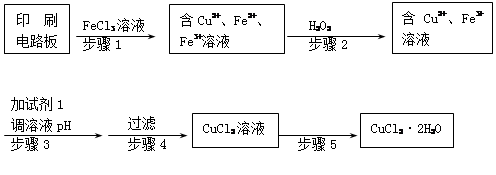
 Cu(OH)2+2HCl,滴加浓盐酸,可以抑制水解
Cu(OH)2+2HCl,滴加浓盐酸,可以抑制水解 Cu(OH)2+2HCl,滴加浓盐酸,就可以抑制水解。③步骤4中洗涤沉淀的操作为向漏斗中加少量蒸馏水(水)至没过沉淀,待水滤干后重复操作2~3次。④步骤3中可选用的“试剂1”是既可以消耗H+同时又不引入杂质离子的物质,可以是CuO[或Cu(OH)2] ,pH=4,c(OH-)=10-10mol/L;由于Ksp(Fe(OH)3)=4×10-38,所以c(Fe3+)·c3(OH-)=4×10-38; c(Fe3+)·c3(OH-)=4×10-38÷10-30=4×10-8mol/L。
Cu(OH)2+2HCl,滴加浓盐酸,就可以抑制水解。③步骤4中洗涤沉淀的操作为向漏斗中加少量蒸馏水(水)至没过沉淀,待水滤干后重复操作2~3次。④步骤3中可选用的“试剂1”是既可以消耗H+同时又不引入杂质离子的物质,可以是CuO[或Cu(OH)2] ,pH=4,c(OH-)=10-10mol/L;由于Ksp(Fe(OH)3)=4×10-38,所以c(Fe3+)·c3(OH-)=4×10-38; c(Fe3+)·c3(OH-)=4×10-38÷10-30=4×10-8mol/L。

 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案科目:高中化学 来源:不详 题型:单选题
| A.制饭勺、饭盒、高压锅等的不锈钢是合金 |
| B.做衣服的棉和麻均与淀粉互为同分异构体 |
| C.煎炸食物的花生油和牛油都是可皂化的饱和酯类 |
| D.磨豆浆的大豆富含蛋白质,豆浆煮沸后蛋白质变成了氨基酸 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
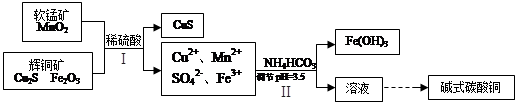
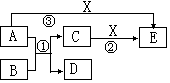
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
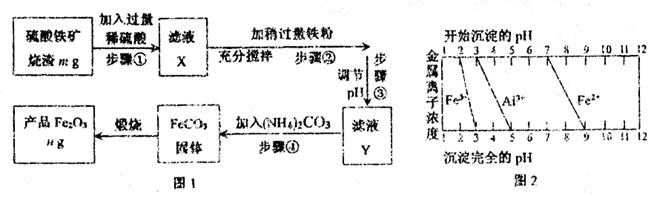
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
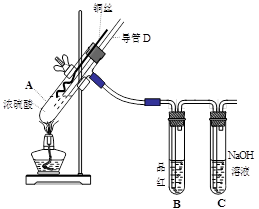
|
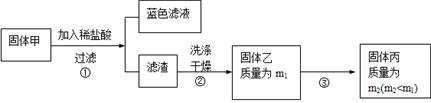 (3) 固体乙在空气中煅烧时,使用的实验仪器除了玻璃棒、三脚架、酒精灯外,还必须有: 。
(3) 固体乙在空气中煅烧时,使用的实验仪器除了玻璃棒、三脚架、酒精灯外,还必须有: 。查看答案和解析>>
科目:高中化学 来源:不详 题型:推断题
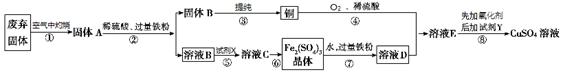
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com