
【题目】已知:
2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol-1
2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(l) ΔH=-1 452 kJ·mol-1
H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·mol-1
下列说法正确的是
A. CH3OH(l)的燃烧热为1 452 kJ·mol-1
B. 同质量的H2(g)和CH3OH(l)完全燃烧,H2(g)放出的热量多
C. ![]() H2SO4(aq)+
H2SO4(aq)+![]() Ba(OH)2(aq)===
Ba(OH)2(aq)===![]() BaSO4(s)+H2O(l) ΔH=-57.3 kJ·mol-1
BaSO4(s)+H2O(l) ΔH=-57.3 kJ·mol-1
D. 3H2(g)+CO2(g)===CH3OH(l)+H2O(l) ΔH=+135.9 kJ·mol
【答案】B
【解析】
A.燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量;
B.设二者质量都是1g,然后根据题干热化学方程式计算;
C.酸碱中和反应生成的硫酸钡过程放热,则其焓变不是-57.3 kJ·mol-1;
D.①2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol-1
②2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(l) ΔH=-1452 kJ·mol-1,按盖斯定律计算①![]() 3-②得到:6H2(g)+2CO2(g)===2CH3OH(l)+2H2O(l) ,据此进行计算。
3-②得到:6H2(g)+2CO2(g)===2CH3OH(l)+2H2O(l) ,据此进行计算。
A.根据2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(l) ΔH=-1452 kJ·mol-1可以知道1mol液态甲醇燃烧生成2mol液态水放出热量为726 kJ·mol-1,则CH3OH(l)燃烧热为726 kJ·mol-1,故A错误;
B.同质量的H2(g)和CH3OH(l)完全燃烧,设质量为1g
2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol-1
2mol 571.6 kJ
![]() mol 142.9 kJ
mol 142.9 kJ
2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(l) ΔH=-1452 kJ·mol-1
2mol 1452 kJ
![]() mol 22.69 kJ
mol 22.69 kJ
所以H2(g)放出的热量多,所以B选项是正确的;
C.反应中有BaSO4(s)生成,而生成BaSO4也是放热的,所以放出的热量比57.3kJ多,即该反应的ΔH<-57.3 kJ·mol-1,故C错误;
D. ①2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol-1
②2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(l) ΔH=-1452 kJ·mol-1,按盖斯定律计算①![]() 3-②得到:6H2(g)+2CO2(g)===2CH3OH(l)+2H2O(l) ΔH=-262.8 kJ·mol-1,则正确的热化学方程式是:3H2(g)+CO2(g)===CH3OH(l)+H2O(l) ΔH=-131.4 kJ·mol-1,故D错误。
3-②得到:6H2(g)+2CO2(g)===2CH3OH(l)+2H2O(l) ΔH=-262.8 kJ·mol-1,则正确的热化学方程式是:3H2(g)+CO2(g)===CH3OH(l)+H2O(l) ΔH=-131.4 kJ·mol-1,故D错误。
所以B选项是正确的。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】食品香精菠萝酯的生产路线(反应条件略去)如下:
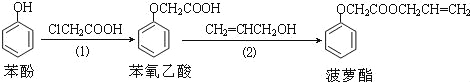
下列叙述错误的是( )
A.步骤(1)产物中残留的苯酚可用FeCl3溶液检验
B.苯酚和菠萝酯均可与酸性KMnO4溶液发生反应
C.苯氧乙酸和菠萝酯均可与NaOH溶液发生反应
D.步骤(2)产物中残留的丙烯醇可用溴水检验
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电解质溶液的说法正确的是
A. 向0.1mol/LCH3COOH溶液中加入少量水,溶液中c(H+)/c(CH3COOH)减小
B. 将CH3COONa溶液从20℃升温至30℃,溶液中c(CH3COO-)/c(CH3COOH)·c(OH-)增大
C. 向盐酸中加入氨水至中性,溶液中c(NH4+)/c(Cl-)>1
D. 向AgCl、AgBr的饱和溶液中加入少量硝酸银,溶液中c(Cl-)/c(Br-)不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在一个2 L的密闭容器中,加入4 mol A和2 mol B进行如下反应3A(g)+2B(g) ![]() 4C(s)+2D(g),反应一段时间后达到平衡,测得生成1.6 mol C,则下列说法正确的是( )
4C(s)+2D(g),反应一段时间后达到平衡,测得生成1.6 mol C,则下列说法正确的是( )
A. 该反应的化学平衡常数表达式是![]()
B. 此时,B的平衡转化率是40%
C. 增大该体系的压强,化学平衡常数增大
D. 增加B,B的平衡转化率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质在适宜的条件下反应,其中氧化剂与还原剂的物质的量之比为2:1的是( )
A. ![]()
B. Fe2O3+2Al![]() Al2O3+2Fe
Al2O3+2Fe
C. CaH2+2H2O===Ca(OH)2+2H2↑
D. 3NO2+H2O===2HNO3+NO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.碳酸钠是一种重要的化工原料,主要采用氨碱法生产。回答下列问题:
(1)已知:①2NaOH(s)+CO2(g)=Na2CO3(s)+H2O(g) ΔH1=127.4kJ/mol
②NaOH(s)+CO2(g) = NaHCO3(s) ΔH2=131.5kJ/mol
反应2NaHCO3(s)=Na2CO3(s) +H2O(g) +CO2(g)的ΔH=____kJ/mol,不同温度下NaHCO3分解反应的平衡常数K313K____K298K(填“大于"“小于”或“等于”),该反应的平衡常数表达式K=______。
(2)向含有BaSO4固体的溶液中滴加Na2CO3溶液,当有BaCO3沉淀生成时溶液中![]() =____。(保留一位小数,已知Ksp(BaCO3)=2.6×109 ,Ksp(BaSO4)=1.1×1010)
=____。(保留一位小数,已知Ksp(BaCO3)=2.6×109 ,Ksp(BaSO4)=1.1×1010)
II.Mg﹣H2O2电池可用于驱动无人驾驶的潜航器,该电池以海水为电解质溶液,其工作原理如图所示,电池总反应是:Mg+H2O2+2H+═ Mg2++2H2O
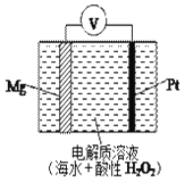
(1)负极材料为_____,发生___反应(填“氧化”或“还原”)
(2)两极电极反应式为:
负极:_________________;正极:_________________;
(3)有4.8gMg反应时时,外电路中转移电子数为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设Na为阿伏加德罗常数的值。已知反应:
①CH4 (g) +2O2 (g) = CO2 (g) +2H2O(l) △H1 =a kJ mol -1
②CH4(g) + 2O2 (g) = CO2 (g) +2H2O(g) △H2 =bkJ mol-1
键能定义:在标准状况下,将1 mol气态分子AB(g)解离为气态原子
A(g)、B(g)所需的能量。已知1 mol氧气的键能为xkJ。其他数据如下 表所示,下列说法正确的是
化学键 | C—O | C—H | O—H |
键能/(kJ mol-1) | 798 | 413 | 463 |
A.上文中x=![]()
B.H2O(g) = H2O(1)的△S<0、△H=(a — b) kJ mol -1
C.当有4NA个O—H键生成时,反应放出的热量为a kJ
D.利用反应①设计的原电池电解精炼铜,当负极输出0.2NA个电子时. 理论上电解槽的阴极质量增重6.4 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某柔性屏手机的柔性电池以碳纳米管作电极材料,以吸收ZnSO4溶液的有机高聚物作固态电解质,其电池总反应为MnO2+![]() Zn+(1+
Zn+(1+![]() ) H2O+
) H2O+![]() ZnSO4
ZnSO4![]() MnOOH+
MnOOH+![]() ZnSO4[Zn(OH)2]3·xH2O.其电池结构如图1所示,图2是有机高聚物的结构片段。下列说法中,不正确的是
ZnSO4[Zn(OH)2]3·xH2O.其电池结构如图1所示,图2是有机高聚物的结构片段。下列说法中,不正确的是

A.碳纳米管具有导电性,可用作电极材料
B.放电时,Zn2+移向MnO2膜
C.充电时,电池的阳极反应为MnOOH- e- = MnO2 + H+
D.合成有机高聚物的单体是
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com