
| m |
| M |
| m |
| M |
| 9g |
| 18g/mol |


科目:高中化学 来源: 题型:
| 物质 | 甲醇 | 苯甲酸 | 苯甲酸甲酯 |
| 沸点/℃ | 64.7 | 249 | 199.6 |
| 相对分子质量 | 32 | 122 | 136 |
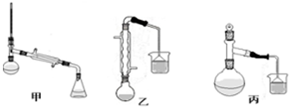
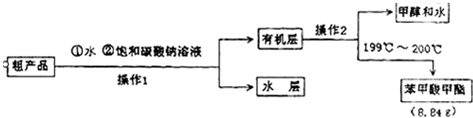
查看答案和解析>>
科目:高中化学 来源: 题型:
| 序号 | 浓硝酸与水的体积比 | 实验现象 |
| Ⅰ | 1:1 | 反应速率快,溶液很快变成蓝色,铜丝表面有大量气泡冒出,气体呈红棕色 |
| Ⅱ | 1:3 | 反应速率较快,溶液变成蓝色,铜丝表面有大量气泡冒出,气体无色 |
| Ⅲ | 1:5 | 反应速率慢,微热后速率加快,溶液变成蓝色,铜丝表面有气泡冒出,气体无色 |
| 影响因素 | 实验步骤 | 实验结论 |
| 金属种类 | 两只烧瓶中各放入5g颗粒大小大致相同的Fe粉、Mg粉,分别加入 | 在该浓度的稀HNO3中,Mg能反应, |
| HNO3浓度 | 两只烧瓶中各放入5g颗粒大小大致相同的Mg粉,分别加入 | 硝酸浓度 |
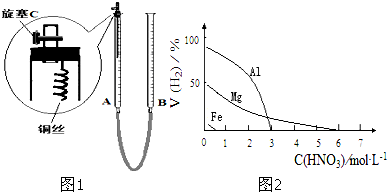
查看答案和解析>>
科目:高中化学 来源: 题型:
A、该反应的化学平衡常数表达式是K=
| ||
| B、此时,B的平衡转化率是35% | ||
| C、增大该体系的压强,平衡向右移动,化学平衡常数 | ||
| D、增加C,B的平衡转化率不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、依据相对分子质量的数据,推测乙醇和丙烷沸点的相对高低 |
| B、依据溶解度数据,选择用萃取的方法将粗溴提纯 |
| C、依据沸点数据,判断用分馏的方法从石油中获取汽油和煤油等 |
| D、依据苯与氢气加成反应的反应热数据与其他烯烃的加成反应对比,研究苯化学键的特征 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、某固体在加入稀盐酸产生了无色无味且能使澄清石灰水变浑的气体,证明该固体一定含有CO32- |
| B、某无色溶液滴加酚酞试液显红色,该溶液不一定是碱 |
| C、加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42- |
| D、某溶液与NaOH溶液共热,产生使湿润蓝色石蕊试纸变红气体,说明原溶液中存在NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
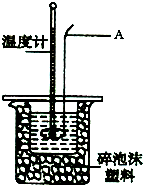 某实验小组用0.50mol?L-1NaOH溶液和0.50mol?L-1.1硫酸溶液进行中和热的测定.
某实验小组用0.50mol?L-1NaOH溶液和0.50mol?L-1.1硫酸溶液进行中和热的测定.| 实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | 温度差(t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.6 | 26.6 | 26.6 | 29.1 | |
| 2 | 27.0 | 27.4 | 27.2 | 31.2 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、是碱性氧化物 |
| B、可置于呼吸面具中提供O2 |
| C、无须密封保存 |
| D、投入水中会使溶液变红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com