
【题目】下列关于燃料充分燃烧的说法,不正确的是 ( )
A. 空气量越多越好B. 应通入适量空气
C. 固体燃料燃烧前要粉碎D. 液体燃料燃烧时可以以雾状喷出
科目:高中化学 来源: 题型:
【题目】利用废蚀刻液(含FeCl2、CuCl2及FeCl3)制备碱性蚀刻液[Cu(NH3)4Cl2溶液和FeCl36H2O的主要步骤:用H2O2氧化废蚀刻液,制备氨气,制备碱性蚀刻液[CuCl2+4NH3=Cu(NH3)4Cl2]、固液分离,用盐酸溶解沉淀并制备FeCl36H2O。下列有关实验说法正确的是( )
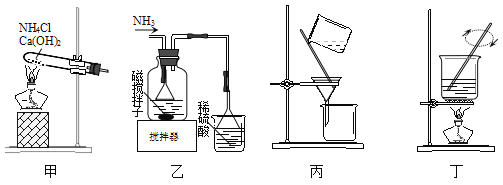
A. 用H2O2氧化废蚀刻液的离子方程式为:2H++2Fe2++H2O2=2Fe3++2H2O
B. 用装置甲可以制备Cu(NH3)4Cl2并沉铁
C. 用装置乙可以分离Cu(NH3)4Cl2溶液和Fe(OH)3
D. 用装置丁由FeCl3溶液制备FeCl36H2O需要经蒸发浓缩、冷却结晶、过滤洗涤等步骤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、M的原子序数依次增大,其中X、Y、Z三种元素中,可形成含二种元素的10电子微粒m、n、p、q,且有反应m+n![]() p↑+q;M的最高价氧化物对应的水化物为最强酸。则下列说法不正确是
p↑+q;M的最高价氧化物对应的水化物为最强酸。则下列说法不正确是
A. 简单离子半径X<Z<Y<M
B. 由X、Y、Z三种元素组成的化合物可以是离子化合物
C. X、Y、Z三种元素组成的化合物的水溶液一定呈酸性
D. MZ2可用于自来水的杀菌消毒
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中错误的是( )
A. 化学反应必然伴随发生能量变化
B. 化学变化中的能量变化主要是由化学键变化引起的
C. 能量变化是化学反应的基本特征之一
D. 化学反应中能量变化的大小与反应物的质量多少无关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】小王同学准备用CuSO4·5H2O配制490 mL 0.1 mol/L的溶液。
(1)小王同学选用的玻璃仪器有:烧杯,玻璃棒,胶头滴管,___。
(2)玻璃棒在该实验中有重要的用途,分别是___和____;
(3)小王同学通过计算,用托盘天平称取___g CuSO4·5H2O。
(4)物质的量浓度误差(填偏高、偏低、无影响)
A.若容量瓶洗净后未干燥,其中残留少量水,则所配制的溶液浓度将_____;
B.定容时,若眼睛俯视,则所配制的溶液浓度将_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计如下实验方案,以分离KCl和BaCl2两种固体混合物,试回答下列问题:

供选试剂:Na2SO4溶液、K2CO3溶液、K2SO4溶液、盐酸
(1)操作①的名称是________,操作②的名称是____________。
(2)试剂a是____________(填化学式,下同),试剂b是__________,固体B是____________。
(3)加入试剂a所发生反应的化学方程式为__________________________________。
加入试剂b所发生反应的化学方程式为____________________________________。
(4)该方案能否达到实验目的:__________________________(填“能”或“不能”)。若不能,应如何改进?(若能,此问不用回答)__________。
(5)若要测定原混合物中BaCl2的质量分数,除了要准确称量混合物的质量外,至少还要获得的数据是____的质量。
查看答案和解析>>
科目:高中化学 来源: 题型:
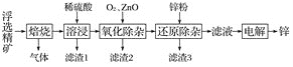
【题目】我国是世界上最早制得和使用金属锌的国家。一种以闪锌矿(ZnS,含有SiO2和少量FeS、CdS、PbS杂质)为原料制备金属锌的流程如图所示:
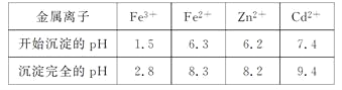
相关金属离子[c0(Mn+)=0.1 mol·L-1]形成氢氧化物沉淀的pH范围如下:
回答下列问题:
(1)焙烧过程中主要反应的化学方程式为__________。
(2)滤渣1的主要成分除SiO2外还有________;氧化除杂工序中ZnO的作用是_____________,若不通入氧气,其后果是___________。
(3)溶液中的Cd2+可用锌粉除去,还原除杂工序中反应的离子方程式为__________。
(4)电解硫酸锌溶液制备单质锌时,阴极的电极反应式为__________;沉积锌后的电解液可返回________工序继续使用。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及其化合物在科学研究和化工生产等领域都有着广泛的应用。请回答下列问题:
(1)与氮元素同族的第四周期元素的基态原子价层电子轨道表达式为___________。
(2)尿素分子的结构简式为:CO(NH2)2,该分子中σ键数目为___________,实验测得:分子中的所有原子在同一平面内,尿素中的碳氧键(125pm)比典型的碳氧双键(121pm)长,而尿素中的碳氮键(137pm)比典型的碳氮单键(147pm)短,说明分子中存在____________。
(3)氨分子构型为_________,氨晶体中,氨分子中的每个H 均参与一个氢键的形成,1 mol固态氨中有_____mol氢键。
(4)通常认为Cu3N是离子晶体,其晶格能可通过图(a)的Born-Haber循环计算得到。

可知, Cu原子的第一电离能为_____kJmol1,N≡N键键能为_____kJmol1,Cu3N晶格能为_____kJmol1。
(5)Cu3N晶体的晶胞如图(b)所示。晶胞边长为anm,晶胞中N3- 位于Cu+所形成的正八 面体的体心,该正八面体的边长为____nm。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com