
| A. | 少量过氧化钠投入AlCl3溶液 | B. | FeCl3溶液与NaHCO3溶液混合加热 | ||
| C. | Ba(OH)2溶液与(NH4)2SO4 | D. | 明矾溶液与小苏打溶液混合 |
分析 A.过氧化钠投入AlCl3溶液中,过氧化钠先和水反应生成氢氧化钠,然后氢氧化钠和AlCl3反应;
B.Fe3+和HCO3-发生双水解,生成二氧化碳气体和氢氧化铁沉淀;
C.钡离子和硫酸根反应生成硫酸钡沉淀,铵根离子和氢氧根离子反应生成氨气;
D.Al3+和HCO3-发生双水解,生成二氧化碳气体和氢氧化铝沉淀.
解答 解:A.过氧化钠投入AlCl3溶液中,过氧化钠与水反应生成氧气和氢氧化钠,NaOH与AlCl3反应生成氢氧化铝白色沉淀,能同时产生无色气体和白色沉淀现象,故A正确;
B.Fe3+和HCO3-发生双水解,生成二氧化碳气体和红褐色氢氧化铁沉淀,不能同时产生无色气体和白色沉淀现象,故B错误;
C.钡离子和硫酸根反应生成硫酸钡白色沉淀,铵根离子和氢氧根离子反应生成氨气,能同时产生无色气体和白色沉淀现象,故C正确;
D.Al3+和HCO3-发生双水解,生成二氧化碳气体和白色氢氧化铝沉淀,故D正确;
故选B.
点评 本题考查学生物质混合以后所能发生的反应,是对物质的性质的考查,注意双水解,难度不大.


科目:高中化学 来源: 题型:解答题
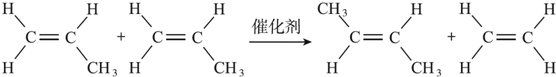
 +CH2=CH2.
+CH2=CH2.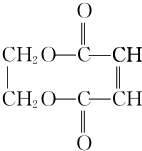 +2H2O.
+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 设计该循环是为了制取能源气体O2 | |
| B. | 整个循环过程中产生1mol O2的同时产生44.8LH2 | |
| C. | 图中反应Ⅰ、Ⅱ、Ⅲ均为氧化还原反应 | |
| D. | 图中反应Ⅰ、Ⅱ、Ⅲ均可在常温常压下进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、Ba2+、N${O}_{3}^{-}$、Cl- | B. | Na+、N${H}_{4}^{+}$、S${O}_{4}^{2-}$、Cl- | ||
| C. | Na+、H+、C${O}_{3}^{2-}$、N${O}_{3}^{-}$ | D. | Na+、K+、Mn${O}_{4}^{-}$、Br- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  | B. |  | C. |  | D. |  |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol Mg转变为Mg2+失去的电子数目为NA | |
| B. | 常温常压下,22.4 L O2含有的分子数目为NA | |
| C. | 1 mol•L-1KOH溶液中含有的钾离子数目为NA | |
| D. | 标准状况下,22.4 L CO2、CO的混合气中含有的碳原子数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 制备Fe(OH)3胶体:0.1 mol•L-1 FeCl3溶液与0.3 mol•L-1 NaOH溶液等体积混合 | |
| B. | 验证溴原子:取C2H5Br少许与NaOH溶液共热,冷却后滴加AgNO3溶液 | |
| C. | 检验Fe2+:取少量待测液,向其中加入适量新制氯水,再滴加KSCN溶液 | |
| D. | 比较AgCl和AgI的溶解度:向2 mL 0.1 mol•L-1 NaCl溶液中滴加数滴同浓度AgNO3溶液,然后再滴入KI溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com