
【题目】反应速率和化学反应的限度是化学反应原理的重要组成部分。
(1)探究反应条件对0.10 mol/L Na2S2O3溶液与0.10 mol/L稀H2SO4反应速率的影响。反应方程式为:Na2S2O3+H2SO4 = Na2SO4+S↓+SO2↑+H2O。设计测定结果如下:
编号 | 反应温度/℃ | Na2S2O3溶液/mL | 水/mL | H2SO4溶液/mL | 乙 |
① | 25 | 10.0 | 0 | 10.0 | x |
② | 25 | 5.0 | a | 10.0 | y |
③ | 40 | 10.0 | 0 | 10.0 | z |
若上述实验①②是探究浓度对化学反应速率的影响,则a为______,乙是实验需要测量的物理量,则表格中“乙”为________________________,x、y、z的大小关系是_______________________。
(2)氨气具有广泛的用途,工业上合成氨的反应是N2(g) +3H2(g) ![]() 2NH3(g)
2NH3(g)
①已知:
化学键 | H—H | N≡N | N—H | 键能kJ/mol(断开1mol化学键所需要的能量) | 436 | 945 | 391 |
则合成氨的热化学方程式是__________________________________________________。
②一定温度下,在一个容积固定的密闭容器中若反应起始时N2、H2、NH3的浓度分别为0.1 mol/L、0. 3 mol/L、0.1 mol/L,达到平衡时NH3浓度c(NH3)的范围是________________________。
③ 下列说法中,能说明上述②中反应已经达到化学平衡状态的是_________________。
a. 1mol N≡N键断裂的同时,有6mol N-H键断裂 b. N2、NH3物质的量浓度不再改变 c. 容器中气体的密度保持不变 d. 容器内N2、 H2物质的量之比为1:3,且保持不变 e. 2 v正(NH3)=3 v逆 (H2)
④在工业生产中,及时分离出NH3,有利于合成氨,用平衡移动原理解释原因是_______________________。
【答案】5 溶液变浑浊所需时间 y>x>z N2(g) +3H2(g) ![]() 2NH3(g) ΔH=-93kJ/mol 0~0.3 a,b 减小生成物浓度,平衡正向移动
2NH3(g) ΔH=-93kJ/mol 0~0.3 a,b 减小生成物浓度,平衡正向移动
【解析】
(1)Na2S2O3溶液与稀H2SO4反应生成二氧化硫和硫沉淀,当探究某一种因素对反应速率的影响时,必须保持其他影响因素一致,要探究Na2S2O3溶液浓度不同对反应速率的影响,则加入的Na2S2O3溶液的体积不同,但反应体积溶液的总体积需相同,故应加入蒸馏水来确保溶液的总体积相同;要准确描述反应速率的快慢,必须准确测得溶液褪色时间的长短;
(2)①根据反应热等于反应物的总键能-生成物的总键能求算;
②可假设反应正向进行或逆向进行达到平衡,并结合可逆反应的限度来判断即可;
③当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态;
④勒沙特列原理是如果改变影响平衡的一个条件(如浓度、压强或温度等),平衡就向能够减弱这种改变的方向移动。
(1)实验①②中的Na2S2O3溶液的加入体积不同,故要探究Na2S2O3溶液浓度不同对反应速率的影响,但溶液的总体积需相同,故应加入蒸馏水来确保溶液的总体积相同,故甲应为V(蒸馏水)/mL,a的值为5.0;又Na2S2O3溶液与稀H2SO4反应生成二氧化硫和硫沉淀,则要准确描述反应速率的快慢,必须准确测得溶液出现浑浊时间的长短,故乙要测量的物理量是出现浑浊的时间,温度越高反应速率越快,浓度越大反应速率越快,速率快,出现浑浊的时间短,已经③的温度最高,①的反应物浓度比②大,则反应出现浑浊的时间 是y>x>z;
(2)①已知合成氨反应N2(g)+3H2(g)![]() 2NH3(g)中需要断裂1个N≡N键和3个H-H键,同时形成6个N-H键,则△H=945kJmol-1+436kJmol-1×3-391kJmol-1×6=-93kJmol-1= -93kJmol-1,则合成氨的热化学方程式是N2(g) +3H2(g)
2NH3(g)中需要断裂1个N≡N键和3个H-H键,同时形成6个N-H键,则△H=945kJmol-1+436kJmol-1×3-391kJmol-1×6=-93kJmol-1= -93kJmol-1,则合成氨的热化学方程式是N2(g) +3H2(g) ![]() 2NH3(g) ΔH=-93kJ/mol。
2NH3(g) ΔH=-93kJ/mol。
②若反应起始时N2、H2、NH3的浓度分别为0.1mol/L、0.3mol/L、0.1mol/L,假设反应正向进行,则N2的最大转化浓度为0.1mol/L,则NH3的变化浓度为0.2mol/L,即平衡时NH3的浓度小于0.3mol/L,假设反应逆向进行,则NH3的变化浓度最大为0.1mol/L,即平衡时NH3的最小浓度为大于0mol/L,故NH3达到平衡时浓度的范围为0mol/L<c(NH3)<0.3mol/L;
③ a.单位时间内1mol N≡N键断裂等效于6mol N-H键形成,同时6mol N-H键断裂,故a正确;
b.当反应达到平衡状态时,N2、NH3物质的量浓度不再改变,故b正确;
c.反应前后气体质量和体积不变,混合气体的密度始终保持不变,不能说明反应达到平衡状态,故c错误;
d.当体系达平衡状态时,n(N2):n(H2)可能等于1:3,也可能不等于1:3,故d错误;
e.当3v正(NH3)=2v逆 (H2)时,反应达到平衡状态,则2 v正(NH3)=3 v逆 (H2)时反应不是平衡状态,故e错误;
故答案为ab;
④根据勒夏特列原理,分离出生成物,会减小生成物浓度,导致平衡正向移动,有利于氨气的合成。


 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】异秦皮啶具有镇痛、安神、抗肿瘤的功效,秦皮素具有抗痢疾杆菌的功效,它们在一定条件下可相互转化(如下图所示),下列有关说法正确的是( )

A. 异秦皮啶转化为秦皮素属于取代反应
B. 异秦皮啶与秦皮素互为同系物
C. 鉴别异秦皮啶与秦皮素可用FeCl3溶液
D. 1 mol秦皮素最多可与3 mol NaOH反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A为淡黄色固体,T为生活中使用最广泛的金属单质,D是具有磁性的黑色晶体,C是无色无味的气体,H是白色沉淀。
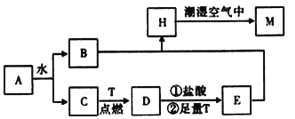
(1)物质D的化学式为 ________。
(2)A和水反应生成B和C的离子方程式为____________________,列出A的一种重要用途_________________。
(3)H在潮湿空气中变成M的实验现象是______________________。
(4)反应①的离子方程式为_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对下列探究反应速率和化学平衡影响因素的四个实验,回答下列问题:
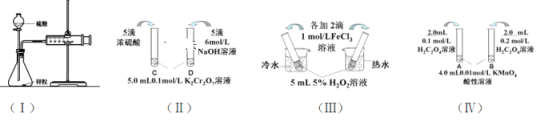
(1)利用实验(Ⅰ)探究锌与1mol/L硫酸和4mol/L硫酸反应的速率,可以测定收集一定体积氢气所用的时间。①此方法需要控制的变量有(至少写出两项):___。②为了衡量反应的快慢,还可以采用新的测定方法是_____。
(2)实验(Ⅱ)已知:Cr2O72- (橙色)+ H2O![]() 2CrO42-(黄色)+ 2H+。D试管中实验现象为_______________________________,用平衡移动原理解释原因:_______________________
2CrO42-(黄色)+ 2H+。D试管中实验现象为_______________________________,用平衡移动原理解释原因:_______________________
(3)实验(Ⅲ)①实验目的是探究____________________。
(4)在室温下进行实验(Ⅳ)①实验目的是_____。②溶液褪色的时间:t(A)________t(B)(填>、<或= )
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2的资源化利用能有效减少CO2排放,又能缓解能源危机。实现CO2资源化再利用的研究工作正在不断进行中。
(1)CO2和H2,合成CH3OH,用非金属催化剂实现CO2电催化还原制备甲醇的反应历程如图所示:
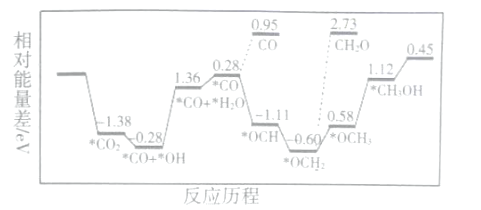
上述合成甲醇的反应速率较慢,要使反应速率加快,主要降低下列变化中___ (填字母)的能量变化。
A.*CO+*OH→*CO+*H2O B.*CO→*OCH
C. *OCH2→*OCH3 D.*OCH3→*CH3OH
(2)CO2和H2合成甲酸(HCOOH)其反应为:H2(g)+CO2(g)![]() HCOOH(g)。一定温度下,恒容密闭容器中进行上述反应,测得v正(CO2)随反应时间(t)的变化如图所示。
HCOOH(g)。一定温度下,恒容密闭容器中进行上述反应,测得v正(CO2)随反应时间(t)的变化如图所示。
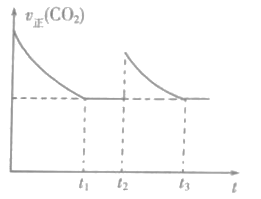
①t2时,改变的条件是充入amolCO2,同时___。
②下列关于t1、t3时刻的说法,正确的是___。
a.平衡常数:K1>K3
b.混合气的平均分子量:![]() <
<![]()
c.混合气中HCOOH的体积分数:V1=V3
③标准平衡常数Kθ=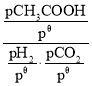 ,其中pθ为标准压强(1×105Pa),pH2、pCO2和pHCOOH为各组分的平衡分压,如pCO2=pxCO2,p为平衡总压,xCO2为平衡系统中CO2的物质的量分数。在标准压强下,向上述容器充入等物质的量的H2和CO2进行反应,测得HCOOH的平衡产率为w,则K=___(用含w字母表示)。
,其中pθ为标准压强(1×105Pa),pH2、pCO2和pHCOOH为各组分的平衡分压,如pCO2=pxCO2,p为平衡总压,xCO2为平衡系统中CO2的物质的量分数。在标准压强下,向上述容器充入等物质的量的H2和CO2进行反应,测得HCOOH的平衡产率为w,则K=___(用含w字母表示)。
(3)O2辅助的Al~CO2电池工作原理如图所示。该电池电容量大,能有效利用CO2,电池反应产物Al2(C2O4)3是重要的化工原料。
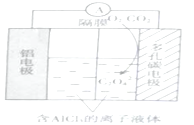
电池正极区发生的反应:①O2+e-=O2-;②___,O2的作用是___。
(4)CH4超干重整CO2得到的CO经偶联反应可制得草酸(H2C2O4)。常温下,向某浓度的草酸溶液中加入一定浓度的KOH溶液,所得溶液的pH=3,则![]() =___。
=___。
(已知常温下H2C2O4的Ka1=6×10-2,Ka2=6×10-5)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知一定温度下合成氨反应:N2+3H2![]() 2NH3 (每生成2 mol NH3放出92.4kJ的热量),在恒温、恒压的密闭容器中进行如下实验:①通入1molN2和3mol H2,达平衡时放出热量为Q1,②通入2 molN2和6 molH2,达平衡时放出热量为Q2,则下列关系正确的是
2NH3 (每生成2 mol NH3放出92.4kJ的热量),在恒温、恒压的密闭容器中进行如下实验:①通入1molN2和3mol H2,达平衡时放出热量为Q1,②通入2 molN2和6 molH2,达平衡时放出热量为Q2,则下列关系正确的是
A. Q2=2Q1=184.8kJB. Q1<0.5Q2
C. Q1<Q2<184.8kJD. Q1 =Q2 <92.4kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于某些离子的检验及结论一定正确的是( )
A.加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有![]()
B.加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有![]()
C.加入AgNO3溶液,生成白色沉淀,加稀硝酸沉淀不溶解时,能确定有Cl-存在
D.加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将一定量的氯气通入100mL4mol·L-1的氢氧化钠溶液中,发生反应的化学方程式为:Cl2+2NaOH=NaCl+NaClO+H2O。充分反应后,下列说法正确的是(NA为阿伏加德罗常数)( )
A.当通入的Cl2为2.24L时,反应中电子转移数目为0.1NA
B.当电子转移数目为0.2NA时,溶液质量增加14.2g
C.当溶液中Na+为0.4NA时,溶液中的Cl-为0.2NA
D.当溶液质量增加7.1g时,溶液中ClO-为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。当它们混合反应时,即产生大量氮气和水蒸气,并放出大量热。已知:0.4 mol液态肼与足量的液态双氧水反应,生成氮气和水蒸气,放出256 kJ的热量。
(1)该反应的热化学方程式为_______________________________________。
(2)又知H2O(l)=H2O(g) ΔH=+44 kJ·mol-1,则16 g液态肼与液态双氧水反应生成液态水时放出的热量是________kJ。
(3)此反应用于火箭推进,除释放大量热和快速产生大量气体外还有一个很大的优点是________________________。
Ⅱ.参考下列图表和有关要求回答问题。
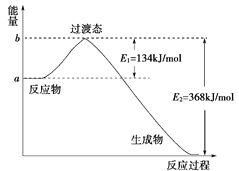
(1)如图是1 mol NO2(g)和1 mol CO(g)反应生成CO2(g)和NO(g)过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:__________________________________;
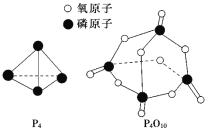
(2)下表是部分化学键的键能数据:
化学键 | P—P | P—O | O=O | P=O |
键能/(kJ/mol) | a | b | c | x |
已知白磷的燃烧热ΔH=-d kJ/mol,白磷及其完全燃烧的产物结构如图所示,则上表中x=______________________(用含有a、b、c、d的代数式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com