
| 所需试剂 | 方法 | |
| 甲烷(乙烯) | 溴水 | 洗气 |
| 苯(酒精) | 水 | 分液 |
| 粗苯甲酸的提纯 | 水 | 重结晶 |
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:选择题
| A. | A原子最外层电子数比B原子最外层电子数少 | |
| B. | A的最高价氧化物对应水化物的碱性强于B的最高价氧化物对应水化物的碱性 | |
| C. | 1molA与足量酸反应生成的H2比1molB与足量酸反应生成的H2多 | |
| D. | 常温时,A、B均能导电,且导电性良好 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
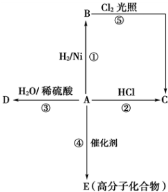 某烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A还是一种植物生长调节剂,A可发生如图所示的 一系列化学反应,其中①②③属于同种反应类型.根据图回答下列问题:
某烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A还是一种植物生长调节剂,A可发生如图所示的 一系列化学反应,其中①②③属于同种反应类型.根据图回答下列问题: ,反应类型加聚反应.
,反应类型加聚反应.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验步骤 | 实验现象 |
| ①将镁条用砂纸打磨后,放入试管中,加入少量水后,加热至水沸腾;再向溶液中滴加酚酞溶液 | A.浮在水面上,熔成小球,四处游动,发出“嘶嘶”声,随之消失,溶液变成红色 |
| ②将一小块金属钠放入滴有酚酞溶液的冷水中 | B.有气体产生,溶液变成浅红色 |
| ③将镁条投入稀盐酸中 | C.反应不十分剧烈;产生无色气体 |
| ④将铝条投入稀盐酸中 | D.剧烈反应,迅速产生大量无色气体 |
| 实验内容 | ① | ② | ③ | ④ |
| 实验现象(填A-D) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度 | K1 | K2 |
| 973K | 1.47 | 2.38 |
| 1173K | 2.15 | 1.67 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | O2-的结构示意图为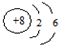 | |
| B. | 某微粒核外电子排布为2、8、8结构,则该微粒一定是氩原子 | |
| C. | NH4+与H3O+具有相同的质子数和电子数 | |
| D. | F-、Na+、Mg2+、Al3+是与He原子具有相同电子层结构的离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com