
| A. | Cu | B. | 熔融的K2SO4 | C. | 乙醇 | D. | NaOH溶液 |
分析 在水溶液里或熔融状态下能导电的化合物是电解质,在水溶液里或熔融状态下都不导电的化合物是非电解质,电解质、非电解质都必须为化合物,单质和混合物一定不是电解质,据此进行解答.
解答 解:A.Cu是单质,所以铜既不是电解质也不是非电解质,故A错误;
B.熔融的K2SO4导电,硫酸钾在水溶液中也导电,且为化合物,则熔融的K2SO4为电解质,故B正确;
C.乙醇不导电,在水溶液中也不导电,乙醇为非电解质,故C错误;
D.氢氧化钠溶液是混合物,所以不是电解质,故D错误;
故选B.
点评 本题考查了电解质与非电解质的判断,难度不大,明确电解质与非电解质的概念为解答关键,注意电解质和非电解质都必须是化合物,单质和混合物既不是电解质也不是非电解质.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:实验题

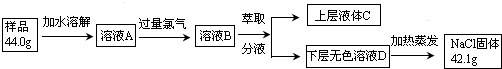

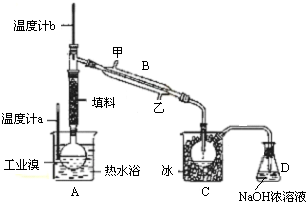
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相同 | |
| B. | 向氟化钠溶液中加入适量氢氟酸,得到的酸性混合溶液:c(Na+)>c(F-)>c(H+)>c(OH-) | |
| C. | 25℃时,等体积pH=3的HA和HB两种酸分别与足量的锌反应,相同时间内HA与Zn反应生成的氢气更多,HA是弱酸 | |
| D. | Na2CO3溶液中加入少量Ca(OH)2固体,CO32-水解程度减小,溶液的pH减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 按I-、Fe2+、Br-的顺序还原性逐渐减弱 | |
| B. | 通入氯气后原溶液中Fe2+一定被氧化 | |
| C. | 原溶液中Br-一定被氧化 | |
| D. | 不能确定通入氯气后的溶液中是否还存在Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学键的形成一定伴随着电子的转移和能量变化 | |
| B. | NaCl和SiC晶体熔化时,克服粒子间作用力的类型相同 | |
| C. | 24Mg32S晶体中电子总数与中子总数之比为1:1 | |
| D. | 某晶体固态不导电水溶液能导电,说明该晶体是离子晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3COOH+CH3CH2OH$?_{△}^{浓H_{2}SO_{4}}$CH3COOCH2CH3+H2O | |
| B. | 2CH3CH2OH+O2$→_{△}^{催化剂}$2CH3CHO+2H2O | |
| C. | CH3CH2Br+NaOH$\stackrel{H_{2}O}{→}$CH3CH2OH+NaBr | |
| D. | 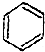 +Br2$\stackrel{FeBr_{3}}{→}$ +Br2$\stackrel{FeBr_{3}}{→}$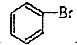 +HBr +HBr |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
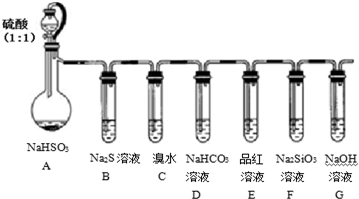
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com