
| 5+3 |
| 2 |


 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:
 ,是一种精细化工产品,是一元中强酸,具有较强还原性.回答下列问题:
,是一种精细化工产品,是一元中强酸,具有较强还原性.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.012 kg12C含有6.02×1023个碳原子 |
| B、1 mol任何物质都含有6.02×1023个原子 |
| C、硫酸的摩尔质量是98 g |
| D、常温常压下,1 mol氧气的体积为22.4 L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、次氯酸钙溶液中通入过量CO2:Ca2++2ClO-+H2O+CO2═CaCO3↓+2HClO |
| B、用碳酸钠溶液吸收少量的二氧化硫:2CO32-+SO2+H2O=2HCO3-+SO32- |
| C、用食醋除去水垢中的CaCO3:CaCO3+2H+=Ca2++H2O+CO2↑ |
| D、NH4HCO3溶液与过量的NaOH溶液反应:NH4++OH-=NH3↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 纯净物 | 混合物 | 强电解质 | 弱电解质 | 非电解质 |
| A | 水煤气 | 大理石 | 苛性钠 | 醋酸 | 二氧化碳 |
| B | 胆矾 | 空气 | 硫酸钠 | 一水合氨 | 石墨 |
| C | 生石灰 | 水煤气 | 盐酸 | 碳酸 | 铜 |
| D | 烧碱 | 汽油 | 硫酸钡 | 水 | 乙醇 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、②中无色气体中有NO,可能含CO2 |
| B、③中沉淀有BaSO4,可能含BaCO3 |
| C、肯定存在的离子是Al3+、SO42-、NO3-、Mg2+,肯定不存在的离子是 Ba2+、Fe2+、CO32-、I-,不能确定的离子是K+、Cl- |
| D、②中红棕色气体通入水中发生反应的离子方程式为:3NO2+H2O=H++NO3-+2NO |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、所有的电子在同一区域里运动 |
| B、能量高的电子在离核远的区域运动,能量低的电子在离核近的区域运动 |
| C、处于最低能量的原子叫基态原子 |
| D、同一原子中,1s、2s、3s所能容纳的电子数越来越多 |
查看答案和解析>>
科目:高中化学 来源: 题型:
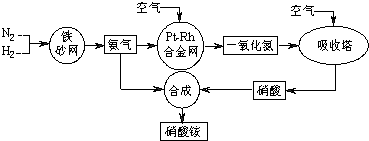
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com