
| 反应时间t/h | 1 | 4 | 9 | 16 | 25 |
| MgO层厚 y/nm | 0.05a | 0.20a | 0.45a | 0.80a | 1.25a |
| 反应时间t/h | 1 | 4 | 9 | 16 | 25 |
| NiO层厚 y′/nm | b | 2b | 3b | 4b | 5b |
| 1 |
| 2 |
| 1 |
| 2 |


科目:高中化学 来源: 题型:
| A、稀释后两溶液的pH相等 |
| B、稀释后甲瓶溶液的pH一定小于乙溶液 |
| C、稀释后甲瓶溶液的pH小于或等于乙溶液 |
| D、稀释后甲瓶溶液的pH一定大于乙溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 硫单质及其化合物在工农业生产中有着重要的应用.
硫单质及其化合物在工农业生产中有着重要的应用.查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
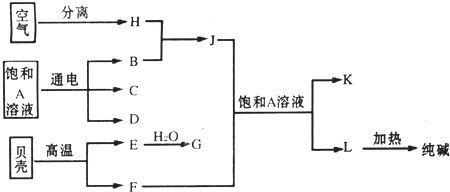

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、金属腐蚀的本质是金属原子失去电子而被氧化 |
| B、将地下钢管与直流电源的正极相连,用来保护钢管 |
| C、电解饱和食盐水制氢氧化钠,可以用铁做阴极 |
| D、氢氧燃料电池中,氢气在负极发生氧化反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com