A、B、C、D、E为原子序数依次增大的五种短周期元素,C与B、E在周期表中相邻,且C、E同主族,原子序数C大于A、B小于E,则C处于第二周期,E处于第三周期,所以B、C、E在周期表中的位置关系为
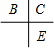
,A和D最外层电子数相同,则二者处于同族,原子序数D大于C小于E,则D为第三周期,其中仅含一种金属元素,D应为金属,B、C的最外层电子数之和等于D的原子核外电子数,D的核外电子数为奇数,则D为钠元素或铝元素,若D为钠元素,则A为氢元素,B为氮元素,C为氧元素,E为硫元素,A和C可形成化合物H
2O、H
2O
2,(相对分子质量H
2O<H
2O
2),符合题意.若D为铝元素,则A为硼元素,B为氧元素,C为氟元素,E为氯元素,A和C形成化合物,不符合题意.故A为氢元素,B为氮元素,C为氧元素,D为钠元素,E为硫元素;甲为H
2O;乙为H
2O
2.
(1)甲为H
2O,氧原子与氢原子之间形成1对共用电子对,结构式为H-O-H;乙为H
2O
2,具有强氧化性,可以杀菌、消毒,
故答案为:H-O-H;杀菌、消毒;
(2)金属易拉罐含有金属铝,A、C、D组成的化合物为NaOH,铝与氢氧化钠反应生成偏铝酸钠与氢气,反应离子方程式为2Al+2OH
-+2H
2O=2(AlOH
2)
-+3H
2↑;氢气易燃易爆,充填气球,易造成安全事故,
故答案为:2Al+2OH
-+2H
2O=2(AlOH
2)
-+3H
2↑;氢气易燃易爆,易造成安全事故;
(3)A、B、C三种元素组成的盐为硝酸铵,具有铵根离子的方法为取适量该溶液于洁净试管中,向试管中加入浓氢氧化钠溶液并加热,用湿润的红色石蕊试纸在管口附近检验.铵根离子水解,溶液呈酸性,溶液中NO
3-浓度最大,
故答案为:取适量该溶液于洁净试管中,向试管中加入浓氢氧化钠溶液并加热,用湿润的红色石蕊试纸在管口附近检验;NO
3-;
(4)C和D形成的化合物与EC
2发生氧化还原反应,则C和D形成的化合物应为Na
2O
2,EC
2为SO
2,Na
2O
2具有强氧化性,SO
2具有较强还原性,Na
2O
2与SO
2发生氧化还原反应生成Na
2SO
4,化学方程式为Na
2O
2+SO
2=Na
2SO
4,故答案为:Na
2O
2+SO
2=Na
2SO
4;
(5)C为氧元素,D为钠元素,两种元素组成的化合物为氧化钠、过氧化钠.该固体粉末可能的组成为Na
2O、Na
2O
2或两者的混合物.将粉末加入水中,若无气体生成,则为Na
2O;若有气体生成,可根据一定量该固体粉末产生气体的量确定其全部为Na
2O
2或是两者的混合物,
故答案为:该固体粉末可能的组成为Na
2O、Na
2O
2或两者的混合物.将粉末加入水中,若无气体生成,则为Na
2O;若有气体生成,可根据一定量该固体粉末产生气体的量确定其全部为Na
2O
2或是两者的混合物.



 课堂练加测系列答案
课堂练加测系列答案 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案 A、B、C、D、E为中学化学常见物质,其中A、C为金属单质,E为非金属单质,下图是它们之间的相互转化关系.请回答:
A、B、C、D、E为中学化学常见物质,其中A、C为金属单质,E为非金属单质,下图是它们之间的相互转化关系.请回答:


