
| A. | 1.1 mol•L-1 | B. | 1.5 mol•L-1 | C. | 1.2 mol•L-1 | D. | 1.0 mol•L-1 |
分析 已知:还原性强弱:I->Fe2+,所以氯气先氧化碘离子,再氧化亚铁离子,根据离子方程式计算.
解答 解:已知:还原性强弱:I->Fe2+,往100mL碘化亚铁溶液中缓慢通入3.36L(标准状况)氯气,氯气先氧化碘离子,再氧化亚铁离子,已知氯气的物质的量为0.15mol,发生反应离子方程式为:Cl2+2I-=2Cl-+I2,碘离子完全氧化后,溶液中有一半的Fe2+被氧化成Fe3+,发生反应离子方程式为:
Cl2+2Fe2+=2Cl-+2Fe3+,设原碘化亚铁溶液的物质的量浓度为cmol/L,则c(I-)=2c(FeI2)=2c,c(Fe2+)=cmol/L,
所以与碘离子反应消耗的氯气为n(Cl2)=$\frac{1}{2}$n(I-)=cV=0.1cmol,
反应完成后溶液中有$\frac{1}{2}$的Fe2+被氧化成Fe3+,则与亚铁离子反应消耗的氯气为n(Cl2)=$\frac{1}{2}$×$\frac{1}{2}$n(Fe2+)=$\frac{1}{4}$cV=0.025cmol,所以0.025cmol+0.1cmol=0.15mol解得:c=1.2mol/L,
故选C.
点评 本题主要考查学生氧化还原反应的有关计算,注意溶液中离子反应的顺序,根据离子方程式计算,难度不大.


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案科目:高中化学 来源: 题型:选择题
| A. | 锌与CH3COOH溶液反应:Zn+2H+═Zn2++H2↑ | |
| B. | 氢氧化铝与稀硝酸反应:H++OH-═H2O | |
| C. | CuCl2溶液与铁粉反应:3Cu2++2Fe═3Cu+2Fe3+ | |
| D. | MgCl2溶液与氨水反应:Mg2++2NH3•H2O═Mg(OH)2↓+2NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧元素与甲、乙、丙形成的二元化合物均只有两种 | |
| B. | 简单离子半径:戊>乙>丙>丁 | |
| C. | 甲、乙、戊三种元素可形成含有共价键的离子化合物 | |
| D. | 丙、丁、戊三种元素的最高价氧化物对应的水化物两两之间均能发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验序号 | 温度℃ | 初始CCl4浓度mol/L | 初始H2浓度mol/L | CCl4的平衡转化率 |
| 1 | 110 | 0.8 | 1.2 | A |
| 2 | 110 | 1 | 1 | 50% |
| 3 | 120 | 1 | 1 | B |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
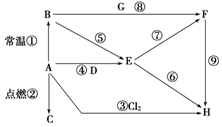 如图表示A~H八种物质的相互转化关系,其中A为金属单质,其余均为化合物,C为淡黄色粉末,D为常见的无色液体,G能使澄清石灰水变浑浊.
如图表示A~H八种物质的相互转化关系,其中A为金属单质,其余均为化合物,C为淡黄色粉末,D为常见的无色液体,G能使澄清石灰水变浑浊.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化铁溶液中加入足量的氨水:Fe3++3OH-═Fe(OH)3↓ | |
| B. | 铁片与稀硝酸反应Fe+2H+═Fe2++H2↑ | |
| C. | 氯气通入氯化亚铁溶液:Cl2+Fe2+═2Cl-+Fe3+ | |
| D. | 氢氧化铝溶于氢氧化钠溶液:Al(OH)3+OH-═AlO2-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向某固体上滴加稀盐酸,有气泡产生,则该固体一定是碳酸盐 | |
| B. | 把燃着的木条插入某瓶无色气体中,木条熄灭,证明瓶中的气体是二氧化碳 | |
| C. | 取少量溶液于试管中,滴加氯化钡溶液,有白色沉淀生成,证明该溶液中一定有硫酸根离子 | |
| D. | 不用任何试剂就可以把KOH、HNO3、CuSO4、MgCl2四种溶液鉴别出来 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| 选项 | X | Y | Z | M |
| A | Fe | FeCl2 | FeCl3 | Cl2 |
| B | Mg | C | CO | CO2 |
| C | NaOH | NaCO3 | NaHCO3 | CO2 |
| D | NH3 | NO | NO2 | O2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 简单离子半径:Y>X>W | B. | 单质的氧化性:W>Y>Z | ||
| C. | 化合物YW2具有强氧化性 | D. | 化合物YW2中只含共价键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com