
下列关于元素周期表的叙述,不正确的是( )
A.ⅡA族中无非金属元素 B.Ⅷ族中所含元素种类最多
C.0族中无金属元素 D.金属元素的种类比非金属元素多
科目:高中化学 来源: 题型:
对于Zn(s)+H2SO4(aq)=ZnSO4(aq)+H2(g) ΔH <0 的化学反应下列叙述不正确的是
A.该反应是放热反应 B.ΔH的值与反应方程式的计量系数有关
C.若将该反应设计成原电池则锌为负极
D.若将其设计为原电池,当有32.5g锌溶解时,正极放出气体一定为11.2L
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z、W是元素周期表中原子序数依次增大的四种短周期元素,其相关信息如下表:
| 元素 | 相关信息 |
| X | X的最高价氧化物对应的水化物化学式为H2XO3 |
| Y | Y是地壳中含量最高的元素 |
| Z | Z的基态原子最外层电子排布式为3s23p1 |
| W | W的一种核素的质量数为28,中子数为14 |
| T | 常温常压下,T单质是淡黄色固体,常在火山口附近沉积 |
| P | P的价层电子排布为[Ar]3d104s2 |
(1)W位于元素周期表第________周期第________族;W的原子半径比X的________(填“大”或“小”)。
(2)TY2中心原子的杂化方式为_______;XY2中一个分子周围有__________个紧邻分子;堆积方式与XY2晶胞类型相同的金属有_________(从“Cu、 Mg、K、Po”中选出正确的),其空间利用率为_______。
(3)Z的第一电离能比Mg的________(填“大”或“小”);写出Z单质与NaOH溶液反应的化学方程式 。
(4)写出W的最高价氧化物与NaOH溶液反应的离子方程式 ;W的最高价氧化物与XY2的熔点较高的是 ,原因是 。
(5)处理含XO、TO2烟道气污染的一种方法,是将其在催化剂作用下转化为单质T。已知:
XO(g)+ 1/2O2(g)====XO2(g) ΔH=-283.0 kJ·mol-1
T(s)+O2(g)=====TO2(g) ΔH=-296.0 kJ·mol-1
此反应的热化学方程式是______________________________。
(6)P在周期表的 区;P和T形成的化合物PT在荧光体、光导体材料、涂料、颜料等行业中应用广泛。立方PT晶体结构如下图所示,其晶胞边长为540.0 pm,密度为_________ g·cm-3(列式并计算)。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法不正确的是 ( )
A.用SO2漂白纸浆和草帽辫
B.用酒精萃取碘水中的碘单质的操作,可选用分液漏斗,然后进行静置、分液
C.高温下用焦炭还原SiO2制取粗硅
D.除观察颜色差别外,区分氯化铁溶液与氢氧化铁胶体较简便的方法是丁达尔效应
查看答案和解析>>
科目:高中化学 来源: 题型:
为了测定某铜银合金的成分,将30.0g合金溶于80mL13.5mol/L的浓硝酸中,
待合金完全溶解后,收集到6.72L(标准状况)NO和NO2的混合气体,并测得溶液中H+浓度为1mol/L。
假设反应后溶液的体积仍为80mL,试计算.
(1)被还原硝酸的物质的量。
(2)合金中银的质量分数。
查看答案和解析>>
科目:高中化学 来源: 题型:
运用元素周期律分析下面的推断,其中错误的是( )
A.硒化氢是无色、有毒、比硫化氢稳定的气体
B.砹化银不溶于水也不溶于稀硝酸
C.硫酸镭是难溶于水的白色固体
D.锗单质是一种优良的半导体材料
查看答案和解析>>
科目:高中化学 来源: 题型:
[化学—选修3:物质结构与性质](15分)
有A、B、C、D、E、F、G、H原子序数递增的前四周期八种元素。请根据下列信息,回答问题:
| ①A、B、C、D、E、F为短周期主族元素,原子半径大小关系为A<D<C<B<F<E; |
| ②A与D形成的化合物常温下为液态; |
| ③B元素原子价电子(外围电子)排布为 |
| ④F元素原子的核外p电子总数比s电子总数多1; |
| ⑤第一电子能:F<E; |
| ⑥G的基态原子核外有6个外成对电子; |
| ⑦H能形成红色(或砖红色)的 |
(1)G元素基态原子的价电子排布图为 。
(2)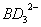 中B原子采取的杂化轨道类型为 。
中B原子采取的杂化轨道类型为 。
(3)根据等电子体原理,推测 分子的空间构型为 。
分子的空间构型为 。
(4)下列有关E、F的叙述正确的是( )
a.离子半径E>F b.电负性E<F
c.单质的熔点E>F d. E、F的单质均能与氧化物发生置换
e. E的氧化物具有两性 f. E、F均能与氯元素构成离子晶体
(5)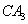 极易溶于
极易溶于 ,原因是 。
,原因是 。
(6)E单质的晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,晶胞如下图丙所示。则E单质的晶体堆积模型为 。
若已知E原子半径为r pm, 表示阿伏伽德罗常数,晶胞的变长为a。晶胞的高为h,则晶胞的密度可表示为 g/cm3。(用只含r和
表示阿伏伽德罗常数,晶胞的变长为a。晶胞的高为h,则晶胞的密度可表示为 g/cm3。(用只含r和 代数式表示)
代数式表示)

查看答案和解析>>
科目:高中化学 来源: 题型:
有机物分子中,当某个碳原子连接着四个不同的原子或原子团时,这种碳原子称为“手性碳原子”。例如,下列有机物分子中带“*”碳原子就是手性碳原子。
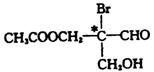 该有机物分别发生下列反应,生成的有机物分子中仍含有手性碳原子的是
该有机物分别发生下列反应,生成的有机物分子中仍含有手性碳原子的是
A.与乙酸发生酯化反应 B.与NaOH水溶液反应
C.与银氨溶液作用发生银镜反应
D.催化剂作用下与H2反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com