
| A. | 油脂是人体不可缺少的营养物质 | |
| B. | 油脂的水解产物是氨基酸 | |
| C. | 油脂主要在小肠中被消化吸收 | |
| D. | 脂肪中多不饱和酸含量越高,其营养价值也越高 |
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案科目:高中化学 来源: 题型:解答题
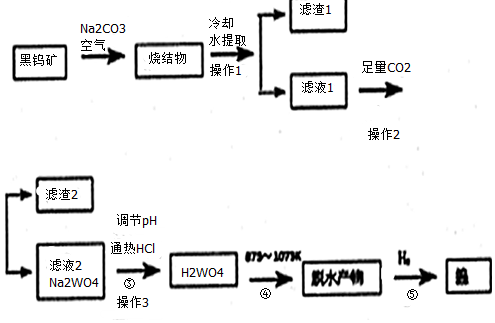
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

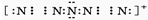 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (m+n)必定小于 p | B. | (m+n)必定大于 p | C. | m 必定小于 p | D. | n 必定大于 p |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
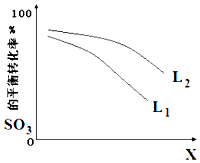 高温裂解法处理工业废硫酸的原理为:2H2SO4(l)=2SO2(g)+O2(g)+2H2O(g)△H=+550kJ/mol,它由两步反应组成:
高温裂解法处理工业废硫酸的原理为:2H2SO4(l)=2SO2(g)+O2(g)+2H2O(g)△H=+550kJ/mol,它由两步反应组成:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含有NA个NO2、N2O4分子的混合气体降低温度,混合气体的分子数目小于NA | |
| B. | 常温常压和光照条件下,33.6 LCl2与3.0g H2反应,生成的HCl分子数目为3NA | |
| C. | 1.68 g Fe和足量水蒸气反应,转移的电子数目为0.09NA | |
| D. | 一定条件下,1 mol N2和3 mol H2充分反应,生成物中含N-H键数目为6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO4-和NO3-可能来自同一工厂 | B. | Cl-和NO3-一定来自不同的工厂 | ||
| C. | Ag+和Na+可能来自同一工厂 | D. | Na+和NO3-来自同一工厂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Q1=2Q2=92.4 | B. | Ql>2Q2 | C. | Q1<2Q2 | D. | Q1=2Q2>92.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 凡是卤代烃在强碱的醇溶液中都能发生消去反应 | |
| B. | 卤代烃发生消去反应的产物一定是烯烃 | |
| C. | 只有烃的衍生物才有官能团 | |
| D. | 二氯乙烷与二氯丙烷互为同系物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com