
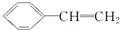 )有下列叙述:
)有下列叙述:| A. | ①②③④⑤ | B. | ①②⑤⑥ | C. | ①②④⑤⑥ | D. | ①②④⑤ |
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 1 mol羟基与17 g NH3所含电子数都为NA | |
| B. | 电解精炼铜的过程中,每转移NA个电子时,阳极溶解铜的质量为32 g | |
| C. | 常温常压下,28 g C2H4、C3H6的混合气体中含有碳原子的数目为2NA | |
| D. | 适量铜粉溶解于1 L 0.5 mol•L-1稀硝酸中,当生成2.24 L NO时,溶液中氮原子数为0.4 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 涂油漆 | |
| B. | 海轮在海洋上航行,为防止船体腐蚀,常在船体上镶上铜块 | |
| C. | 在金属表面进行电镀 | |
| D. | 改变金属内部结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 20% | B. | 50% | C. | 66.7% | D. | 80% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Z的气态氢化物稳定性强于其它的非金属气态氢化物 | |
| B. | 原子半径:Z>Y>X | |
| C. | CaY2与水发生氧化还原反应时,CaY2只作氧化剂 | |
| D. | CaX2、CaY2和CaZ23种化合物中,阳离子与阴离子个数比均为1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碱性溶液中:Rb+、Cs+、CH3COO-、Br- | B. | 饱和溴水中 I-、NO3-、Na+、SO32- | ||
| C. | D+、Cl-、NO3-、SiO32- | D. | Ag+、Fe3+、Br-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
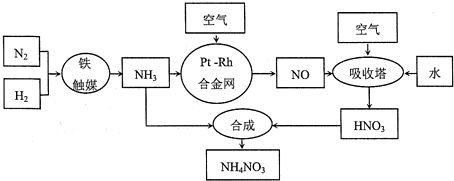
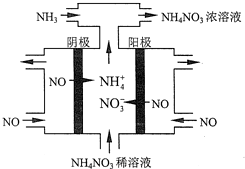
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com