
利用Ksp计算溶液中某种离子的浓度
已知室温时AgBr的溶解度是8.8×10-7 mol·L-1,MgNH4PO4溶解度是6.3×10-5 mol·L-1,求AgBr、MgNH4PO4的溶度积.
|
答:AgBr的溶度积为7.7×10-13,MgNH4PO4的溶度积为2.5×10-13. AgBr(s) 因为溶解的AgBr可认为完全电离 所以c(Ag+)=c(Br-)=8.8×10-7 mol·L-1 Ksp(AgBr)=c(Ag+)·c(Br-)=(8.8×10-7)2=7.7×10-13 同理MgNH4PO4(s) 因为溶解的Mg(NH4)PO4可认为完全电离, 所以c(Mg2+)=c( 所以Ksp(MgNH4PO4)=c(Mg2+)c( |


科目:高中化学 来源: 题型:阅读理解
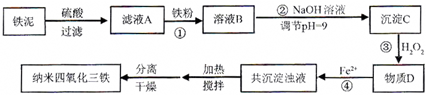
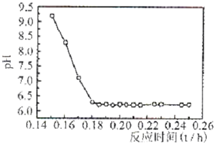
| 实验序号 | 双氧水(mL) | pH | 反应时间 |
| 1 | 0.5 | 11 | 3 |
| 2 | 0.4 | 11 | 3 |
| 3 | 0.6 | 11 | 3 |
| 4 | 0.5 | 10 | 3 |
| 5 | |||
| 6 | |||
| 7 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
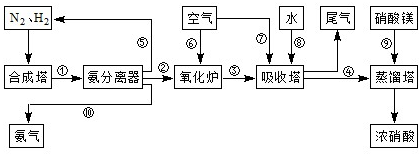
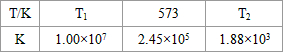
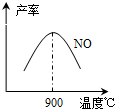 (3)NH3和O2在铂系催化剂作用下从145℃就开始反应:4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H=-905kJ?mol-1,不同温度下NO产率如右图所示.温度高于900℃时,NO产率下降的原因
(3)NH3和O2在铂系催化剂作用下从145℃就开始反应:4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H=-905kJ?mol-1,不同温度下NO产率如右图所示.温度高于900℃时,NO产率下降的原因查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
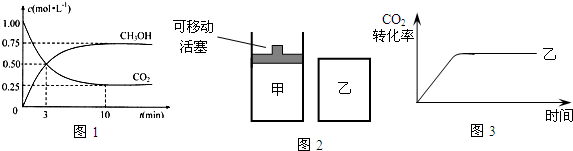
查看答案和解析>>
科目:高中化学 来源: 题型:
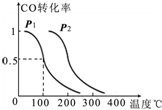
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com