
| A. | 实验室用大理石和稀盐酸制取CO2:2H++CO32-=CO2↑+H2O | |
| B. | 铁和稀盐酸反应:2Fe+6H+=3H2↑+2Fe3+ | |
| C. | 在氢氧化钡溶液中加入少量小苏打:Ba2++2OH-+2HCO3-=BaCO3↓+CO32-+2H2O | |
| D. | 碳酸氢钙溶液和稀盐酸反应:HCO3-+H+=CO2↑+H2O |
分析 A.碳酸钙为难溶物,不能拆开;
B.铁与稀盐酸反应生成氯化亚铁和氢气;
C.小苏打为碳酸氢钠,碳酸氢钠少量,反应生成碳酸钡沉淀、氢氧化钠和水;
D.反应实质为碳酸氢根离子与氢离子反应生成二氧化碳气体和水.
解答 解:A.大理石的主要成分是碳酸钙,难溶于水,不能拆,正确的离子方程式为;2H++CaCO3=Ca2++H2O+CO2↑,故A错误;
B.铁和稀盐酸反应生成亚铁离子,正确的离子方程式为:Fe+2H+=H2↑+Fe2+,故B错误;
C.在氢氧化钡溶液中加入少量小苏打,离子方程式按照碳酸氢钠的化学式组成书写,正确的离子方程式为:Ba2++OH-+HCO3-=BaCO3↓+H2O,故C错误;
D.碳酸氢钙溶液和稀盐酸反应的离子方程式为:HCO3-+H+=CO2↑+H2O,故D正确;
故选D.
点评 本题考查离子反应方程式的正误判断,题目难度中等,明确在离子反应中哪些物质应保留化学式及反应的实质是解答本题的关键,试题培养了学生的灵活运用能力.


 出彩同步大试卷系列答案
出彩同步大试卷系列答案科目:高中化学 来源: 题型:解答题

| Mn(OH)2 | Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
| 开始沉淀时 | 8.3 | 6.3 | 2.7 | 4.7 |
| 完全沉淀时 | 9.8 | 8.3 | 3.7 | 6.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在4mL0.1mol/L的K2Cr2O7溶液中滴加数滴1mol/LNaOH溶液,溶液颜色从橙色变成黄色 | |
| B. | 向血红色的Fe(SCN)3溶液中加入少量KI固体,溶液颜色变浅 | |
| C. | 在试管中加入少量氯化钴晶体,滴加浓盐酸溶解后加水稀释至紫色,将试管置于热水中片刻,溶液颜色变成粉红色 | |
| D. | 用50mL针筒抽取30mL红棕色的NO2气体并封住注射孔,当用力推压活塞,压缩针筒中的气体(此过程中不考虑温度变化),从针筒顶端观察,气体颜色逐渐变浅 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 如图所示,水槽中的试管内有一枚铁钉,放置数天观察.
如图所示,水槽中的试管内有一枚铁钉,放置数天观察.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 75.77%表示35Cl的质量分数 | |
| B. | 35.5表示氯元素的近似相对原子质量 | |
| C. | 24.23%表示35Cl的丰度 | |
| D. | 36.966表示37Cl的质量数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 纯水具有较弱的导电性 | B. | 水分子在任何条件下都能发生电离 | ||
| C. | 常温下水能发生电离 | D. | 水的电离是一个可逆反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
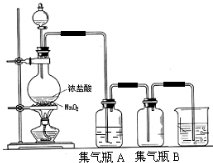 实验室中所用少量氯气是用下列方法制取的,4HCl(浓)+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$Cl2↑+MnCl2+2H2O
实验室中所用少量氯气是用下列方法制取的,4HCl(浓)+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$Cl2↑+MnCl2+2H2O查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com