
|
反应:CO(g)+H2O(g)=CO2(g)+H2(g)的能量变化如图所示,有关该反应的说法正确的是
| |
| [ ] | |
A. |
该反应为吸热反应 |
B. |
1 mol CO2(g)和1 mol H2(g)反应生成1 mol CO(g)和1 mol H2O(g)要放出41 kJ热量 |
C. |
反应的热化学方程式是:CO(g)+H2O(g)=CO2(g)+H2(g) ΔH=+41 kJ/mol |
D. |
CO(g)与H2O(g)所具有的总能量大于CO2(g)与H2(g)所具有的总能量 |
 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案科目:高中化学 来源: 题型:
 二甲醚(CH3OCH3)是一种重要的清洁能源,工业上制二甲醚是在一定的温度(230~290℃)和催化剂条件下进行的,反应中发生了下列一些反应:CO(g)+2H2(g)
二甲醚(CH3OCH3)是一种重要的清洁能源,工业上制二甲醚是在一定的温度(230~290℃)和催化剂条件下进行的,反应中发生了下列一些反应:CO(g)+2H2(g)
|
|
|
|
查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下铁可以和CO2发生反应:
Fe(s)+CO2(g)FeO(s)+CO(g);△H>0
(1)一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2气体和CO气体的浓度与时间的关系如图所示,求8分钟内CO的平均反应速率v(CO)= 。
(2)下列措施中能使平衡时c(CO)/c(CO2)增大的是 (填序号)。
A.升高温度 B.增大压强 C.充入一定量氮气 D.再加入一些铁粉
(3)反应达到平衡后,若保持容器体积不变时,再通入少量的CO2,则CO2的转化率将
(填“增大”、“减小”、“不变”)
(4)铁的重要化合物在生产生活中应用十分广泛。
①FeSO4溶液与稍过量的NH4HCO3溶液混合,可得含FeCO3的浊液。若FeCO3浊液长时间暴露在空气中,固体表面会变为红褐色,写出由FeCO3生成红褐色物质的反应的化学方程式: 。
②高铁酸钠(Na2FeO4)是一种新型饮用水消毒剂。高铁酸钠生产方法之一是:强碱性溶液中用NaClO氧化Fe(OH)3生成高铁酸钠、氯化钠和另一种常见化合物,该反应的离子方程式为 。
(5)已知:2CO(g) + O2(g)== 2CO2(g);△H=-566kJ·mol-1
2H2(g) + O2(g) == 2H2O(g);△H=-483.6kJ·mol-1
写出CO和H2O(g)作用生成CO2和H2的热化学方程式:
。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮专题冲刺第5讲 化学反应与能量练习卷(解析版) 题型:填空题
(1)2012年伦敦奥运会火炬采用丙烷为燃料。丙烷热值较高,污染较小,是一种优良的燃料。试回答下列问题:

①如图是一定量丙烷完全燃烧生成CO2和1 mol H2O(l)过程中的能量变化图,请在图中的括号内填入“+”或“-”。
②写出表示丙烷燃烧热的热化学方程式:___________________________________。
③二甲醚(CH3OCH3)是一种新型燃料,应用前景广阔。1 mol二甲醚完全燃烧生成CO2和液态水放出1 455 kJ热量。若1 mol丙烷和二甲醚的混合气体完全燃烧生成CO2和液态水共放出1 645 kJ热量,则混合气体中,丙烷和二甲醚的物质的量之比为________。
(2)盖斯定律认为:不管化学过程是一步完成或分几步完成,整个过程的总热效应相同。试运用盖斯定律回答下列问题:
①已知:H2O(g)=H2O(l) ΔH1=-Q1 kJ/mol C2H5OH(g)=C2H5OH(l) ΔH=-Q2 kJ/mol
C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g) ΔH3=-Q3 kJ/mol
若使46 g液态无水酒精完全燃烧,并恢复到室温,则整个过程中放出的热量为________kJ。
②碳(s)在氧气供应不充足时,生成CO同时还部分生成CO2,因此无法通过实验直接测得反应: C(s)+ O2(g)=CO(g)的ΔH。但可设计实验、利用盖斯定律计算出该反应的ΔH,计算时需要测得的实验数据有________。
O2(g)=CO(g)的ΔH。但可设计实验、利用盖斯定律计算出该反应的ΔH,计算时需要测得的实验数据有________。
查看答案和解析>>
科目:高中化学 来源:2010-2011学年四川省高三第四次月考化学试卷 题型:选择题
在一个容积固定的密闭容器中,发生反应:CO(g)+2H2(g)  ?CH3OH(g);ΔH<0。第2 min时只改变一个条件,反应情况如下表:
?CH3OH(g);ΔH<0。第2 min时只改变一个条件,反应情况如下表:
|
时间 |
c(CO)/ mol/L |
c(H2)/mol/L |
c(CH3OH)/ mol/L |
|
起始 |
1 |
3 |
0 |
|
第2 min |
0.8 |
2.6 |
0.2 |
|
第4 min |
0.4 |
1.8 |
0.6 |
|
第6 min |
0.4 |
1.8 |
0.6 |
下列说法不正确的是
A.第4 min至第6 min该化学反应处于平衡状态
B.第2 min时,如果只改变某一条件,则改变的条件可能是降低温度
C.第2 min时,如果只改变某一条件,则改变的条件可能是使用催化剂
D.第6 min时,其他条件不变,如果升高温度,正反应速率增大
查看答案和解析>>
科目:高中化学 来源:2010年山西省高二上学期10月考化学 题型:选择题
在容积可变的密闭容器中存在如下反应:CO(g)+H2O(g)
 CO2(g)+H2(g) ΔH<0,下列对图像的分析中不正确的是( )
CO2(g)+H2(g) ΔH<0,下列对图像的分析中不正确的是( )
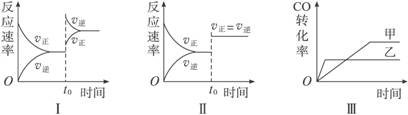
A.图Ⅰ研究的是t0时升高温度对反应速率的影响
B.图Ⅱ研究的是t0时增大压强(缩小体积)或使用催化剂对反应速率的影响
C.图Ⅲ研究的是催化剂对化学平衡的影响,且甲使用了催化剂
D.图Ⅲ研究的是温度对化学平衡的影响,且乙的温度较高
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com