

分析 (1)原电池能将化学能转化成电能,能自发进行的氧化还原反应可设计成原电池;
(2)根据反应Zn+CuSO4=ZnSO4+Cu可知,Zn为负极,则正极可以是活泼性不如Zn的金属,如Cu等,也可以是碳棒,电解质溶液应为CuSO4,据此解答;
(3)锌锰电池Zn在负极失电子,则电池使用过程中,锌会逐渐溶解:Zn=Zn2++2e-,碳棒为正极,因为废电池对环境会造成污染,所以许多国家对废电池进行回收.
解答 解:(1)Zn+CuSO4=ZnSO4+Cu是自发进行的氧化还原反应,可设计成原电池,中和反应无电子转移,不能设计成原电池,
故答案为:A;
(2)根据反应可知,Zn为负极,则正极可以是活泼性不如Zn的金属,如Cu等,也可以是碳棒,电解质溶液应为CuSO4,工作时,锌失电子,电子沿导线流向正极铜,铜离子在正极得电子发生还原反应,电极反应为Cu2++2e-=Cu,装置图为: ,
,
故答案为: 还原;Cu2++2e-=Cu;
还原;Cu2++2e-=Cu;
(3)①锌锰电池Zn在负极失电子,碳棒为正极,故答案为:碳棒;
②锌锰电池Zn在负极失电子,则电池使用过程中,锌会逐渐溶解反应式为:Zn=Zn2++2e-,故答案为:Zn-2e-═Zn2+;
③因为废电池对环境会造成污染,所以许多国家对废电池进行回收,故答案为:废电池对环境会造成污染.
点评 本题考查原电池的设计和工作原理,为常考题型,注意把握原电池的组成和原理,注重基础知识的积累,题目难度不大.


 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案科目:高中化学 来源: 题型:推断题
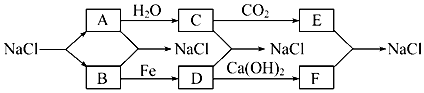
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 铜电极应与Y电极相连接 | |
| B. | H十透过质子交换膜由左向右移动 | |
| C. | 当N电极消耗0.25mol气体时,则铁电极增重16g | |
| D. | M电极反应式为:CO(NH2)2+H2O-6e-═CO2↑+N2↑+6H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Ni(OH)2 |
| 开始沉淀的pH | 1.1 | 6.5 | 3.5 | 7.1 |
| 沉淀完全的pH | 3.2 | 9.7 | 4.7 | 9.2 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 浓硫酸和铜制SO2 | B. | 用Cu与浓HNO3反应制NO2 | ||
| C. | 用 NH4Cl 与 Ca(OH)2反应制 NH3 | D. | 用锌粒与稀H2SO4反应制H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 常温下,将等体积的盐酸和氨水分别加水稀释,溶液的导电性与溶液体积的变化曲线如图所示.下列说法正确的是( )
常温下,将等体积的盐酸和氨水分别加水稀释,溶液的导电性与溶液体积的变化曲线如图所示.下列说法正确的是( )| A. | 曲线Ⅱ表示氨水加水稀释过程中溶液导电性的变化 | |
| B. | 溶液的pH大小关系:c>b>d | |
| C. | 由水电离出的n(OH- ):b>c | |
| D. | 若将b、d两点溶液混合,则:c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 某研究小组欲研究Fe2+的部分性质.
某研究小组欲研究Fe2+的部分性质.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学式 | 电离平衡常数 |
| HCN | K=4.9×10-10 |
| CH3COOH | K=1.8×10-5 |
| H2CO3 | K1=4.4×10-7,K2=4.7×10-11 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com