
【题目】I.(1)下列右侧对左侧物质的描述与左侧任何物质都不对应的是_________(填右侧小写的编号);
物质 描述
A.四氧化三铁 a.自来水消毒剂
B.过氧化钠 b.工业制玻璃
C.碳酸氢钠 c.红色油漆和涂料
D.硅酸钠 d.木材防火剂
E.明矾 e.呼吸面具中氧气的来源
F.青铜 f.制光纤的材料
G.硅 g.用量最大的金属材料
H.氯气 h.焰色反应为绿色
II.(2)明矾溶液中加少量Ba(OH)2溶液的离子方程式 ______________;
(3)漂白粉溶液中通过量CO2的离子方程式________________;
(4)将KFe2Si3O8(OH)2改写为氧化物的形式________________,1mol KFe2Si3O8(OH)2和足量稀盐酸反应,消耗HCl的物质的量为________mol;
(5)配平下面的离子方程式,并用双线桥表示反应的电子转移:______
SO32- + MnO4- + — SO42-+ Mn2+ +______
III.(6)若要除去下列物质中的杂质(括号内为杂质),请将选用的试剂填入表格。
物质(杂质) | 试剂 |
NaHCO3溶液(Na2CO3) | ①______ |
FeCl3溶液(FeCl2) | ②______ |
SiO2(CaCO3) | ③______ |
Fe2O3(SiO2) | ④______ |
【答案】b c f g 2Al3+ + 3SO42- + 3Ba2+ + 6OH- = 2Al(OH)3↓+ 3BaSO4↓ ClO- + CO2 + H2O = HCO3- + HClO K2O·2FeO·Fe2O3·6SiO2·2H2O, 6 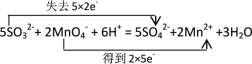 过量CO2 Cl2 盐酸 NaOH溶液
过量CO2 Cl2 盐酸 NaOH溶液
【解析】
I.⑴过氧化钠是呼吸面具中氧气的来源;碳酸氢钠的焰色反应为绿色;硅酸钠主要作木材防火剂;氯气常作自来水消毒剂。
II.⑵明矾溶液中加少量Ba(OH)2溶液,按照少定多变的思想书写。
⑶漂白粉溶液中通过量CO2生成碳酸氢钙和次氯酸。
⑷将KFe2Si3O8(OH)2同时扩大2倍改写为氧化物的形式,主要是K2O·2FeO·Fe2O3在消耗盐酸,根据量的关系计算消耗盐酸的物质的量。
⑸配平下面的离子方程式,亚硫酸根升高2个价态,高锰酸根降低5个价态,根据得失电子守恒进行配平,再用双线桥表示反应的电子转移。
III.⑹ NaHCO3溶液(Na2CO3)用足量二氧化碳与碳酸钠反应生成碳酸氢钠;FeCl3溶液(FeCl2),用足量氯水或通氯气与氯化亚铁反应生成氯化铁;SiO2(CaCO3),加盐酸,碳酸钙与盐酸反应后再过滤得到二氧化硅,Fe2O3(SiO2),加氢氧化钠等强碱溶液反应生成易溶于水的硅酸盐,再过滤得到氧化铁。
I.⑴过氧化钠是呼吸面具中氧气的来源;碳酸氢钠的焰色反应为绿色;硅酸钠主要作木材防火剂;氯气常作自来水消毒剂,因此b、c、f、g没有对应关系,故答案为:b、c、f、g。
II.⑵明矾溶液中加少量Ba(OH)2溶液,按照少定多变的思想,写出的离子方程式 2Al3+ + 3SO42- + 3Ba2+ + 6OH-= 2Al(OH)3↓+ 3BaSO4↓;故答案为:2Al3+ + 3SO42- + 3Ba2+ + 6OH-= 2Al(OH)3↓+ 3BaSO4↓。
⑶漂白粉溶液中通过量CO2生成碳酸氢钙和次氯酸,其离子方程式ClO- + CO2 + H2O = HCO3- + HClO;故答案为:ClO- + CO2 + H2O = HCO3- + HClO。
⑷将KFe2Si3O8(OH)2改写为氧化物的形式,同时扩大2倍得到K2O·2FeO·Fe2O3·6SiO2·2H2O,1mol KFe2Si3O8(OH)2和足量稀盐酸反应,主要是K2O·2FeO·Fe2O3·在消耗盐酸,因此消耗HCl的物质的量为6mol;故答案为:K2O·2FeO·Fe2O3·6SiO2·2H2O;6。
⑸配平下面的离子方程式,亚硫酸根升高2个价态,高锰酸根降低5个价态,根据得失电子守恒进行配平,得到离子方程式,并用双线桥表示反应的电子转移:
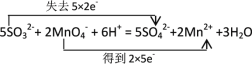 ,故答案为:
,故答案为: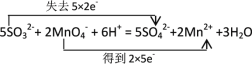 。
。
III.⑹ NaHCO3溶液(Na2CO3)用足量二氧化碳与碳酸钠反应生成碳酸氢钠;FeCl3溶液(FeCl2),用足量氯水或通氯气与氯化亚铁反应生成氯化铁;SiO2(CaCO3),加盐酸,碳酸钙与盐酸反应后再过滤得到二氧化硅,Fe2O3(SiO2),加氢氧化钠等强碱溶液反应生成易溶于水的硅酸盐,再过滤得到氧化铁;故答案为:过量CO2;Cl2;盐酸;NaOH溶液。


科目:高中化学 来源: 题型:
【题目】现有金属单质 A、B 和气体甲、乙、丙以及物质 C、D、E、F,它们之间能发生如下反应。(图中有些反应的产物和反应条件没有标出)
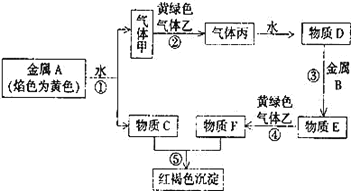
请回答下列问题:
(1) A 的化学式为_____,F 的化学式为_____;
(2) 写出 C 溶液与 Al 反应的离子方程式_____。
(3) 写出 C 溶液与黄绿色气体乙反应的化学方程式_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】糖类、油脂、蛋白质是维持人体生命活动所必需的营养物质,下列叙述不正确的是( )
A.将碘酒滴到土豆片上,土豆片变蓝,说明碘元素均遇淀粉变蓝
B.工业上常用油脂在碱性条件下的水解反应来制肥皂
C.加热条件下,葡萄糖溶液能与新制![]() 悬浊液反应产生砖红色沉淀
悬浊液反应产生砖红色沉淀
D.蛋白质在浓硝酸作用下能发生颜色反应,可用来鉴别部分蛋白质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】荧光棒的发光原理是利用过氧化氢氧化某草酸二酯产生能量传递给荧光物质发出荧光。该草酸二酯的结构简式如下图所示。下列有关该草酸二酯的说法不正确的是
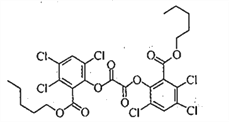
A. 分子中含有一种含氧官能团
B. 苯环上的一溴代物只有一种
C. 可以发生取代反应和加成反应
D. lmol草酸二酯与NaOH溶液反应最多消耗4mol NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.3 molMnO2和100mL 12 mol/L的浓盐酸混合后缓慢加热,充分反应后向剩余的溶液中加入足量的AgNO3溶液,生成AgCl沉淀的物质的量为(不考虑HCl的挥发)( )
A.等于0.6molB.小于0.6mol
C.大于0.6mol,小于1.2molD.等于1.2mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】平达喜是常用的中和胃酸的药物,它的化学成分是AlxMgy(OH)zCO3·nH2O,其中氢元素的质量分数为0.040。取该碱式盐3.01g,加入2.0mol/L盐酸使其溶解,当逐滴加入盐酸42.5mL时,开始产生CO2,加入盐酸至45.0mL时正好反应完全。若在上述碱式盐溶于盐酸后的溶液中加入过量的氢氧化钠,过滤、洗涤,沉淀物进行干燥后重1.74g。请计算该试样中:
(1)碳酸根的物质的量_____________;
(2)镁离子的物质的量_____________;
(3)通过计算确定该物质的化学组成为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)25℃时,某FeCl3溶液的pH=2,则由水电离产生的总c(OH-)=____________;用离子方程式表示FeCl3溶液用于净水的原因____________________________________。
(2)已知NaHSO4在水中的电离方程式NaHSO4=Na++H++SO42-。在NaHSO4溶液中c(H+)___________c(OH-)+c(SO42-)(填“>”、“=”或“<”下同);用硫酸氢钠与氢氧化钡溶液制取硫酸钡,若溶液中SO42-完全沉淀,则反应后溶液的pH__________7。
(3)将0.02mol/LNa2SO4溶液与某浓度BaCl2溶液等体积混合,则生成BaSO4沉淀所需原BaCl2溶液的最小浓度为_________________________________。(已知Ksp(BaSO4)=1.1×10-10)
(4)一定温度下,测得某纯水的pH为6.5。此时水的离子积常数Kw为_______;若在此纯水中加一定量Ba(OH)2固体,配制成0.005mol·L-1的Ba(OH)2溶液,保持原温度,其溶液的pH为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过实验得出的结论正确的是
A.某溶液中加入酸性KMnO4溶液褪色,则原溶液一定含有I-
B.某固体试样加水溶解,取上层清液,加KSCN溶液出现红色,原固体中一定含Fe3+
C.通过元素分析测定某无机固体样品的组成是MgH2C2O6,该固体不可能是碱式碳酸镁
D.某碱性水样滴加稀盐酸无沉淀,再加BaCl2溶液,出现白色沉淀,则原水样中一定含![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述不正确的是( )
A.80 g硝酸铵中含有氮原子数为NA
B.0.1 molN5+离子中所含的电子数为3.4NA
C.1 mol甲烷和NA个甲烷分子的质量相等
D.16 g氧气和16 g臭氧所含的原子数均为NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com