
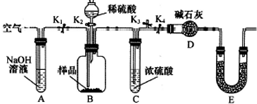
 某研究性学习小组对Cu与H2SO4反应的产物种类和性质进行探究.
某研究性学习小组对Cu与H2SO4反应的产物种类和性质进行探究.硫酸/mol•L-1 | 黑色物质出现的温度/°C | 黑色物质消失的温度/°C |
| 15 | 约150 | 约236 |
| 16 | 约140 | 约250 |
| 18 | 约120 | 不消失 |
分析 Ⅰ、(1)图表数据分析铜和浓硫酸反应过程中会生成黑色物质证明有副反应,浓度合适会避免黑色固体出现,浓度越大,温度越高黑色越难消失;
(2)CuS消失是和浓硫酸反应生成硫酸铜、二氧化硫和水;
Ⅱ、(1)沉淀为氢氧化铜的是碳酸氢钠和硫酸铜在水溶液中发生双水解生成分析;
(2)①空气中含有二氧化碳,空气通过氢氧化钠溶液吸收空气中的二氧化碳,利用除去二氧化碳的空气,打开K1、K3,关闭K2、K4,排除装置中的含二氧化碳气体的空气,避免测定误差的产生;
②若沉淀样品的质量为m g,若沉淀样品为纯净物,则判断沉淀为CuCO3,装置D的质量增加了n g,为二氧化碳气体质量,依据碳元素守恒得到mn的关系;若假设三正确,依据生成的二氧化碳物质的量减少碳酸铜质量,根据样品质量计算得到氢氧化铜的质量分数.
解答 解:Ⅰ、(1)依据图表数据分析可知,浓度不同时出现黑色物质的时间随浓度增大减小,浓度为18mol/L时生成的黑色物质不能消失;
a.分析过程可知.发生的反应过程中生成二氧化硫和硫酸铜的反应过程中有奇谈反应发生生成黑色物质,铜与浓硫酸反应时所涉及的反应可能不止一个,故A符合;
b.图表数据分析可知硫酸浓度选择适当,可避免最后产物中出现黑色物质,故B符合;
c.浓硫酸和铜的反应浓度小于15mol/L也可能出现黑色物质,出现的时间长,该反应发生的条件不一定是硫酸浓度≥15mol•L-1,故C不符合;
d.图表数据中,18mol/L的浓硫酸,出现褐色物质的时间短,黑色物质难以消失,所以硫酸浓度越大,黑色物质越快出现、越难消失,故d符合;
故答案为:abd;
(2)CuS消失是和浓硫酸反应生成硫酸铜、二氧化硫和水,反应的化学方程式为:CuS+4H2SO4=CuSO4+4SO2↑+4H2O,
故答案为:CuS+4H2SO4=CuSO4+4SO2↑+4H2O;
Ⅱ、(1)沉淀为氢氧化铜的判断依据是碳酸氢钠和硫酸铜在水溶液中发生双水解生成,反应的离子方程式为Cu2++2HCO3-=Cu (OH)2↓+2CO2↑,
故答案为:Cu2++2HCO3-=Cu (OH)2↓+2CO2↑;
(2)①空气中含有二氧化碳,空气通过氢氧化钠溶液吸收空气中的二氧化碳,利用除去二氧化碳的空气,打开K1、K3,关闭K2、K4,排除装置中的含二氧化碳气体的空气,避免测定误差的产生;
故答案为:排尽装置中空气中的CO2使测定结果准确;
②若沉淀样品的质量为100g,若沉淀样品为CuCO3和Cu(OH)2的混合物,依据生成的二氧化碳物质的量计算减少碳酸铜质量,根据样品质量计算得到氢氧化铜的质量分数=$\frac{100g-\frac{22g}{44g/mol}×124g/mol}{100g}$×100%=38%,若不进行步骤C,生成的二氧化碳气体中含有水蒸气,被装置D吸收后称量得到二氧化碳质量增大,计算得到碳酸铜质量增大,氢氧化铜的质量减小,则会使测得结果质量分数偏低,
故答案为:38%;偏低.
点评 本题考查了物质组成和性质的分析判断,实验过程分析,沉淀生成的原理,掌握基础是关键,题目难度中等.


 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案 周周清检测系列答案
周周清检测系列答案科目:高中化学 来源: 题型:选择题
| A. | 制取一氧化氮 | B. | 制取乙烯 | C. | 制取乙炔 | D. | 氢气还原氧化铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
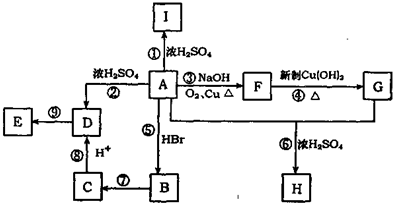
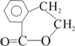 ;
; ;写出反应⑦的化学方程式
;写出反应⑦的化学方程式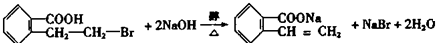 ;
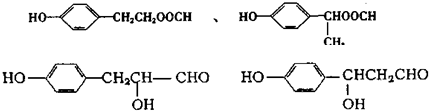
;
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
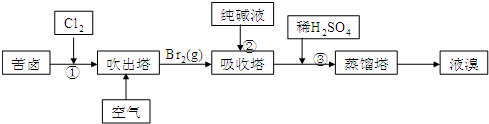
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D | |
| 两极材料 | 石墨、石墨 | Zn片、Cu片 | Zn片、Cu片 | 石墨、Cu片 |
| 插入溶液 | H2SO4溶液 | 乙醇溶液 | 稀盐酸 | H2SO4溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
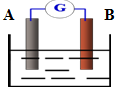 如图为某原电池装置:
如图为某原电池装置:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
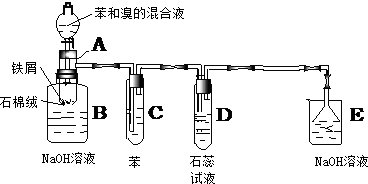

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 32gO2和32gO3的质子数均为16NA | |
| B. | 23gNa与O2在加热条件充分反应,O2得到的电子数为2NA | |
| C. | 在标准状况下,22.4LSO3所含分子数为NA | |
| D. | 2 L1mol•L-1的HC1溶液中,含有的HC1分子数目为2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com