
| A�� | ������������Ӧ������ͬ | |
| B�� | �������з�Ӧ��ƽ�ⳣ�������������з�Ӧ��ƽ�ⳣ�� | |
| C�� | �������е�������ɫ���������е�������ɫ�� | |
| D�� | �������� H2��ת��������������HI��ת����֮�͵���1 |
���� A���������д�����Ӧ��ʼ����ƽ�⣬�������д��淴Ӧ��ʼ���ƽ�⽨����;������ͬ��
B�����������൱������������ƽ��Ļ������ټ���1mol H2��1mol I2��g������Ӧ������Ӧ���У����������е���ƽ��ʱ�¶ȸ��ߣ��÷�Ӧ����Ӧ�Ƿ��ȷ�Ӧ���¶�Խ��ƽ�ⳣ��ԽС��
C�����������������ƽ��״̬���൱������������ƽ��Ļ����Ͻ����¶ȣ�ƽ��������Ӧ�ƶ���
D���¶���ͬʱ����������H2 ��ת��������������HI��ת����֮�͵���1�����������������ƽ��״̬���൱������������ƽ��Ļ����Ͻ����¶ȣ�ƽ��������Ӧ�ƶ���
��� �⣺A���������д�����Ӧ��ʼ����ƽ�⣬�������д��淴Ӧ��ʼ���ƽ�⽨����;������ͬ�����ȽϷ�Ӧ���ʣ���A����
B�����������൱������������ƽ��Ļ������ټ���1mol H2��1mol I2��g������Ӧ������Ӧ���У����������е���ƽ��ʱ�¶ȸ��ߣ��÷�Ӧ����Ӧ�Ƿ��ȷ�Ӧ���¶�Խ��ƽ�ⳣ��ԽС�������������з�Ӧ��ƽ�ⳣ�������������з�Ӧ��ƽ�ⳣ������B��ȷ��
C�����������������ƽ��״̬���൱������������ƽ��Ļ����Ͻ����¶ȣ�ƽ��������Ӧ�ƶ������������е�������ɫ���������е�������ɫ���C����
D���¶���ͬʱ������I��H2 ��ת��������������HI��ת����֮�͵���1�����������������ƽ��״̬���൱������������ƽ��Ļ����Ͻ����¶ȣ�ƽ��������Ӧ�ƶ���HI��ת���ʱ���������ͬ�¶�ʱ��������HI��ת���ʵͣ�����������H2 ��ת��������������HI��ת����֮��С��1����D����
��ѡB��
���� ���⿼��Ӱ�컯ѧƽ������ء���ѧƽ��Ľ����ȣ��ѶȽϴ���ƽ�⽨����;�����бȽ��ǹؼ���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
| ������ҽ�ƻ����ٴ����������浥 | ||||
| ������Ŀ | ����� | ��λ | �ο���Χ | |
| 1 | �Zn�� | 115.92 | ��mol/L | 66-120 |
| 2 | ����Fe�� | 6.95�� | mmol/L | 7.52-11.82 |
| 3 | �ƣ�Ca�� | 1.68 | mmol/L | 1.55-2.10 |
| �� | ||||
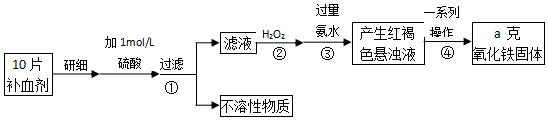
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| �� | �� | �� | |
| A | H2SO4 | NaOH | BaCO3 |
| B | H2S | K2CO3 | CuSO4 |
| C | NaHSO4 | NaOH | CaCl2 |
| D | HNO3 | KOH | Na2O |
| A�� | A | B�� | B | C�� | C | D�� | D |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ±��Ʒ�п���������������Ϊ��ɫ�� | |
| B�� | ��Ѫ���ڷ�Һ�����ӵ�ά����C��Ϊ������ | |
| C�� | �й��Ŵ���������Һ��ͭ������ͭ��ij���� | |
| D�� | �±���װ���ڷ���С��������Ҫ��Ϊ����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 500mL��Һ������K+��SO42-����Ϊ0.3NA | |
| B�� | 500mL��Һ�к���0.1NA��K+���� | |
| C�� | 1L��Һ��K+����Ũ����0.2mol/L | |
| D�� | 2L��Һ��SO42-����Ũ����0.4mol/L |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
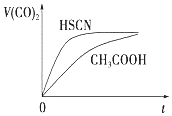 ��֪ 25��ʱ����������ʵĵ���ƽ�ⳣ�����������
��֪ 25��ʱ����������ʵĵ���ƽ�ⳣ�����������| ��ѧʽ | HSCN | CH3COOH | H2CO3 | HClO |
| ����ƽ�ⳣ�� | 1.3��10-1 | 1.8��10-5 | Ka1=4.3��10-1Ka2=5.6��10-1 | 3.0��10-8 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��50mL��Ͳ��ȡ2.35mLϡ���� | |
| B�� | ��������ƽ��5.56gKCl���� | |
| C�� | ����100mlLŨ��Ϊ1 mol/L��ʳ��ˮ���ʳ��5.9g | |
| D�� | �þƾ�������ȡ��ˮ�еĵ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ñ�����Һ����ͭ���ʵ���Ũ��Ϊc=$\frac{4a}{v}$ mol•L-1 | |
| B�� | �ñ�����Һ������ͭ����������Ϊw=$\frac{16a}{a+b}$% | |
| C�� | 25������ͭ���ܽ��Ϊ S=$\frac{1600a}{9a+25b}$g | |
| D�� | �ñ�������ͭ��Һ���ܶ�Ϊ��=$\frac{a+b}{v}$g•L-1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
| A�� | ����������ϲ����ʳ�������ߵ����ɣ������Dz�����û���� | |
| B�� | �����Dz�����û���ǣ�������ʳ�������� | |
| C�� | ����ֻ���ӳ��̻����̵�������Ӧ��ѯҽ�� | |
| D�� | ������Ӧ�ٳԺ��ǵ�ʳƷ���ð˱���δ���ǣ����Է���ʳ�� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com