
用铁制备较纯净的三氧化二铁,下列实验方案最好的是( )
A.使铁在潮湿的空气中缓慢氧化
B.铁在氯气中燃烧,加水溶解,加入足量NaOH溶液,过滤、洗涤、然后充分加热分解
C.使铁溶解于稀硫酸,然后加入足量NaOH溶液,过滤、洗涤,然后充分加热分解
D.使铁与足量稀硝酸反应,然后加入足量NaOH溶液,过滤、洗涤,然后充分加热分解
 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案科目:高中化学 来源: 题型:
 甲、乙为单质,丙、丁为化合物,它们之间存在如下图所示的转化关系。
甲、乙为单质,丙、丁为化合物,它们之间存在如下图所示的转化关系。
(1)若甲、乙均为非金属,丙为氧化物,则:
①乙为氧化产物时,乙可能是________(填一种物质的化学式),按照元素周期表推测,此时反应物甲可能是________(填一种物质的化学式);
②乙为还原产物时,丁所属的物质类别是________。
(2)若该转化关系为我国古代湿法冶炼金属乙的原理,写出此反应的化学方程式________。若该转化关系为高温火法冶炼金属乙的原理,且同时生成的丁是一种有刺激性气味的气体,则丙可能为________(填一种物质的化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组中的X和Y两种原子,化学性质一定相似的是 ( )。
A.X原子和Y原子最外层都只有1个电子
B.X原子的核外电子排布式为1s2,Y原子的核外电子排布式为1s22s2
C.X原子的2p能级上有3个电子,Y原子的3p能级上有3个电子
D.X原子核外M层上仅有2个电子,Y原子核外N层上仅有2个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验方案合理的是( )。
A.用通入酸性高锰酸钾溶液的方法除去乙烯中混有的二氧化硫
B.用加入浓溴水的方法分离苯和苯酚的混合物
C.用灼热的铜丝网除去N2中混有的少量O2
D.用燃烧的方法除去CO2中混有的少量CO
查看答案和解析>>
科目:高中化学 来源: 题型:
Fe、Cu都是人类最早使用的金属。某校化学研究性学习小组的同学运用实验手段研究Fe、Cu的相关性质,请你参与研究并完成下列各题:
(1)甲同学取一束细铜丝用砂纸打磨后放在酒精灯上加热至红热,然后迅速伸入盛Cl2的集气瓶中。你认为甲同学在实验中应该观察到的现象是__________________________________________________________________________________________________________________________________________。
(2)乙同学为探究Fe在冷浓硝酸和热浓硝酸中的反应情况,设计了如图所示的实验装置:
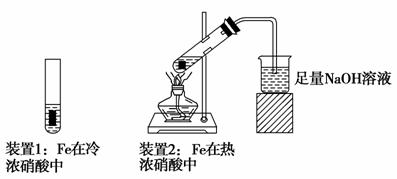
①乙同学发现装置1中Fe未溶解,其原因是________________________________________________________________________;
②装置2生成的气体(假定为NO2和NO混合气体)全部通入100 mL 4 mol·L-1 NaOH溶液,恰好被完全吸收,反应为:NO+NO2+2NaOH===2NaNO2+H2O 2NO2+2NaOH===NaNO2+NaNO3+H2O
若生成NaNO3和NaNO2物质的量之比为1∶3,则混合气体中NO2和NO的体积比为________。
(3)丙同学在Fe和浓硝酸反应后的溶液中加入一块Cu片,Cu片先逐渐溶解,反应一段时间后不再溶解。
①丙同学依据反应现象得出Cu片溶解的原因是和HNO3发生反应。他依据的反应现象是_______________________________________________
________________________________________________________________________。
②丁同学认为丙同学的结论不完全正确,他的理由是
________________________________________________________________________。
(4)请你设计实验证明(3)反应后的溶液中只含Fe2+而不含Fe3+。说明具体实验操作和实验现象:________________________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
除去下列物质中所含的杂质。选用的试剂正确的是 ( )。
| 选项 | 物质(杂质) | 试剂 |
| A | Al2O3(SiO2) | NaOH溶液 |
| B | CO2(SO2) | Na2CO3溶液 |
| C | FeCl2溶液(FeCl3) | Fe粉 |
| D | NaHCO3溶液(Na2CO3) | Ca(OH)2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列标明电子转移的方向和数目的化学方程式中正确的是-----;其中属于歧化反应的是---,属于归中反应的是-----,属于部分氧化还原反应的是-----。
①2KClO3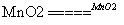 2KC得6e-l+3O失6e-2↑
2KC得6e-l+3O失6e-2↑
②Cl2+2NaOH===NaC失2e-l+NaC得2e-lO+H2O
③6HCl(浓)+KClO3===KC得6e-l+3C失6e-l2↑+3H2O
④4HCl(浓)+M2e-nO2 MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
⑤Cu+4HN2e-O3(浓)===Cu(NO3)2+2NO2↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)铁及其化合物在生活、生产中有广泛应用。请回答下列问题:
①黄铁矿(FeS2)是生产硫酸和冶炼钢铁的重要原料。其中一个反应为3FeS2+8O2 6SO2+Fe3O4,氧化产物为________,若有3 mol FeS2参加反应,转移________mol电子。
6SO2+Fe3O4,氧化产物为________,若有3 mol FeS2参加反应,转移________mol电子。
②与明矾相似,硫酸铁也可用作净水剂,其原理为_______________________________
____________(用离子方程式表示)。
③FeCl3与氢碘酸反应时可生成棕色物质,该反应的离子方程式为____________________。
(2)已知:S2O 有较强的还原性,实验室可用I-测定K2S2O8样品的纯度,反应方程式为
有较强的还原性,实验室可用I-测定K2S2O8样品的纯度,反应方程式为
S2O +2I-===2SO
+2I-===2SO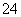 +I2①
+I2①
I2+2S2O ===2I-+S4O
===2I-+S4O ②
②
S2O 、S4O
、S4O 、I2氧化性强弱顺序:______________________。
、I2氧化性强弱顺序:______________________。
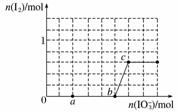
(3)已知溶液中,还原性为HSO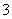 >I-,氧化性为IO
>I-,氧化性为IO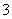 >I2>SO
>I2>SO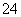 。在含3 mol NaHSO3的溶液中逐滴加入KIO3溶液,加入的KIO3和析出的I2的物质的量的关系曲线如图所示。
。在含3 mol NaHSO3的溶液中逐滴加入KIO3溶液,加入的KIO3和析出的I2的物质的量的关系曲线如图所示。
①a点处的还原产物是__________(填离子符号);
b点→c点反应的离子方程式是_________________________________。
②当溶液中的I-为0.5 mol时,加入的KIO3可能是________ mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com