
| 反应时间/min | n(A)/mol | n(B)/mol |
| 0 | 1.00 | 1.20 |
| 10 | 0.50 | |
| 30 | 0.20 |
| A. | 前10 min内反应的平均速率为 v(C)=0.050 mol•L-1•min-1 | |
| B. | 保持其他条件不变,起始时向容器中充入0.50 mol A气体和0.60 mol B气体,到达平衡时,n(C)>0.25 mol | |
| C. | 若密闭容器体积可变,其他条件不变,在达到平衡后持续缩小容器体积,则平衡一直会正向移动 | |
| D. | 温度为T2℃时(T1>T2),上述反应平衡常数为20,则正反应为放热反应 |
分析 A.由表中时间可知,10min内A的物质的量变化量为1mol-0.5mol=0.5mol,由方程式可知C的物质的量变化量为0.5mol,根据v=$\frac{\frac{△n}{V}}{△t}$计算v(C);
B.由表中数据可知,10min内A的浓度变化量为1mol-0.5mol=0.5mol,由方程式可知B的浓度变化量为2×0.5mol=1mol,10s时B浓度为0.2mol,10min时到达平衡,据此平衡时C的物质的量.
保持其他条件不变,起始时向容器中充入0.50 mol A气体和0.60 mol B气体,等效为原平衡体积增大一倍,降低压强,A的转化率降低,据此判断;
C.在达到平衡后持续缩小容器体积,压强增大,平衡正向移动;
D.计算温度T1℃时,该反应平衡常数,根据升高温度平衡常数的变化判断平衡移动方向,据此解答.
解答 解:A.由表中时间可知,10min内A的浓度变化量为1mol-0.5mol=0.5mol,由方程式可知C的浓度变化量为0.5mol,故v(C)=$\frac{\frac{0.5mol}{2L}}{10min}$=0.025 mol•L-1•min-1,故A错误;
B.由表中数据可知,10min内A的浓度变化量为1mol-0.5mol=0.5mol,由方程式可知B的浓度变化量为2×0.5mol=1mol,10s时B浓度为0.2mol,10min时到达平衡,由方程式可知C的浓度变化量为0.5mol.保持其他条件不变,起始时向容器中充入0.50 mol A气体和0.60 mol B气体,等效为原平衡体积增大一倍,降低压强,A的转化率降低,故平衡时n(C)<0.25 mol,故B错误;
C.在达到平衡后持续缩小容器体积,压强增大,平衡正向移动,则平衡一直会正向移动,故C正确;
D.由表中时间可知,10min内A的物质的量变化量为1mol-0.5mol=0.5mol,A的浓度变化量为$\frac{0.5mol}{2L}$=0.25mol/L,则:
A(g)+2B(g)?C(g)
开始(mol/L):0.5 0.6 0
变化(mol/L):0.25 0.5 0.25
平衡(mol/L):0.25 0.1 0.25
故该温度下平衡常数k=$\frac{0.25}{0.25×0.{1}^{2}}$=100,
降低为T2℃时,上述反应平衡常数为20,降低温度,平衡向逆反应进行,故正反应为吸热反应,故D错误;
故选C.
点评 本题考查反应速率计算、影响化学平衡因素、化学平衡常数等,难度中等,注意B选项可以根据平衡常数计算C的具体值,学生容易忽略.


科目:高中化学 来源: 题型:选择题
| A. | 1LCO2中含有3NA个原子 | |
| B. | 1molCl2含有1NA个原子 | |
| C. | 23g钠在足量的Cl2中反应,转移电子数NA个 | |
| D. | 欲配制1.00L1.00mol•L-1的NaCl溶液,可将58.5gNaCl溶于1.00L水中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合气体密度 | B. | 容器内气体的压强 | ||
| C. | 混合气体的平均相对分子质量 | D. | A的转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知 H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ•mol-1,则 H2SO4和Ba(OH)2反应的反应热△H=2×(-57.3)kJ•mol-1 | |
| B. | 葡萄糖的燃烧热是2800 kJ•mol-1,则 $\frac{1}{2}$C6H12O6(s)+3O2(g)═3CO2(g)+3H2O(l)△H=-1400kJ•mol-1 | |
| C. | H2(g)的燃烧热是285.8 kJ•mol-1,则 2H2O(g)═2H2(g)+O2(g)△H=+571.6 kJ•mol-1 | |
| D. | 燃料电池中将甲醇蒸气转化为氢气的热化学方程式是 CH3OH(g)+$\frac{1}{2}$O2(g)═CO2(g)+2H2(g)△H=-192.9 kJ•mol-1,则 CH3OH(g)的燃烧热为 192.9 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
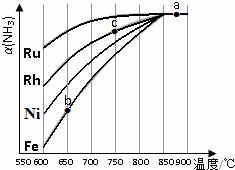 氨气在生产、生活和科研中应用十分广泛
氨气在生产、生活和科研中应用十分广泛查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 绿色化学的核心是应用化学原理对环境污染进行治理 | |
| B. | PM2.5表面积大,能吸附大量的有毒有害物质,对人的肺功能造成很大危害 | |
| C. | 二氧化硅广泛应用于太阳能电池、计算机芯片 | |
| D. | 汽车尾气中含有大量大气污染物,这是汽油不完全燃烧造成的 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | MgO固体(SiO2),加过量NaOH溶液充分反应,过滤、洗涤、干燥 | |
| B. | CO2(SO2),酸性KMnO4溶液、浓硫酸,洗气 | |
| C. | KNO3晶体(NaCl),蒸馏水溶解、蒸发、结晶、过滤、洗涤、干燥 | |
| D. | FeCl3溶液(CuCl2),过量铁粉,过滤 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
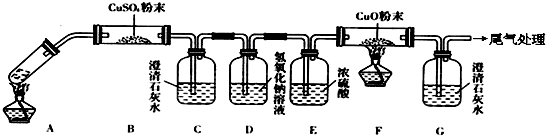
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com