
氧化铝有两种变体,一种是α?Al2O3,一种是γ?Al2O3,γ?Al2O3可用Al(OH)3在723 K时加热制得,它不耐酸;α?Al2O3是天然刚玉的主要成分,硬度很大,且对酸有极强的稳定性。α?Al2O3可以用γ?Al2O3高温煅烧制得。已知氧化铝可由铝铵矾加热制得,铝铵矾[(NH4)Al(SO4)2·12H2O]受强热分解的产物为:Al2O3、NH3、N2、SO3、SO2和H2O。
(1)写出铝铵矾受强热分解的化学方程式_____________________________________
________________________________________________________________________,
氧化产物是________,还原产物是________,它们的物质的量之比为________。
(2)在含有1 mol的铝铵矾溶液中,需加入________molBa(OH)2,沉淀的物质的量最大,离子方程式为______________________________________________________________
________________________________________________________________________。
(3)将上述反应中的Al2O3加入适量的氧化铬,在氢氧焰上强热,熔融后使其结晶,可以制成人造红宝石,可用于做激光器材和装饰品。所得人造红宝石是哪种Al2O3的变体?________,如何用简单方法证明是该变体______________________________________
________________________________________________________________________。
(1)4(NH4)Al(SO4)2·12H2O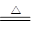 2Al2O3+2NH3↑+N2↑+5SO3↑+3SO2↑+53H2O↑
2Al2O3+2NH3↑+N2↑+5SO3↑+3SO2↑+53H2O↑
N2 SO2 1∶3
(2)2 NH4++Al3++2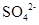 +2Ba2++4OH-===Al(OH)3↓+2BaSO4↓+NH3·H2O
+2Ba2++4OH-===Al(OH)3↓+2BaSO4↓+NH3·H2O
(3)α-Al2O3 取少量试样加足量稀盐酸,若溶解,为γ-Al2O3,若不溶解,为α-Al2O3
【解析】
试题分析:(1)铝铵矾受强热分解的生成物可知,该反应的化学方程式是4(NH4)Al(SO4)2·12H2O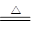 2Al2O3+2NH3↑+N2↑+5SO3↑+3SO2↑+53H2O↑;其中氮元素的化合价从-3价升高到0价,失去3个电子,所以氮气是氧化产物。S元素的化合价从+6价降低到+4价,得到2个电子,因此SO2是还原产物。根据电子的都是守恒可知,氮气和SO2的物质的量之比是1∶3。
2Al2O3+2NH3↑+N2↑+5SO3↑+3SO2↑+53H2O↑;其中氮元素的化合价从-3价升高到0价,失去3个电子,所以氮气是氧化产物。S元素的化合价从+6价降低到+4价,得到2个电子,因此SO2是还原产物。根据电子的都是守恒可知,氮气和SO2的物质的量之比是1∶3。
(2)1mol NH4)Al(SO4)2·12H2O中含有1molNH4+、1molAl3+、2molSO42-,所以要使生成的沉淀物质的量最多,则需要2mol氢氧化钡,反应的离子方程式是NH4++Al3++2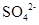 +2Ba2++4OH-===Al(OH)3↓+2BaSO4↓+NH3·H2O。
+2Ba2++4OH-===Al(OH)3↓+2BaSO4↓+NH3·H2O。
(3)人造红宝石是α-Al2O3,由于α-Al2O3不能溶解再盐酸中,而γ-Al2O3可以溶解盐酸中,据此可以鉴别。
考点:考查氧化还原反应方程式的书写、氧化产物、还原产物的判断和计算,离子方程式的书写以及沉淀多少的计算和氧化铝变体的判断
点评:该题是高考中的常见考点,所以中等难度的试题。试题接近高考,贴近生活,基础性强,难易适中。有利于培养学生的逻辑推理能力和发散思维能力,更有利于培养学生分析问题、解决问题的能力。


 智慧小复习系列答案
智慧小复习系列答案科目:高中化学 来源: 题型:022
氧化铝有两种变体,一种是a-Al2O3,另一种是g-Al2O3。g-Al2O3可用Al(OH)3在723K时加热制得,它不耐酸;a-Al2O3是天然刚玉的主要成分,硬度很高,且对酸有极强稳定性。a-Al2O3可以用g-Al2O3于高温煅烧制得。已知氧化铝可由铝铵明矾加热制得,铝铵明矾[NH4Al(SO4)2×12H2O]受强热分解的产物为Al2O3,NH3,N3,SO3,SO2和H2O。
(1)写出铝铵明矾受强热分解的化学方程式:________________________,氧化产物是________,还原产物是________,它们的物质的量之比为________。
(2)把上述反应中的Al2O3加入适量氧化铬在氢氧焰上强热熔融后,使其结晶可以制成人造红宝石,可用于做激光器材和装饰品。所得人造红宝石是哪种Al2O3的变体? ________。怎样用简便方法说明它确实是该种Al2O3的变体? ________。
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)写出铝铵明矾受强热分解的化学方程式:______________________________________。氧化产物是___________________,还原产物是___________________,它们的物质的量之比为___________________。
(2)在含1 mol的铝铵明矾的溶液中,需加入___________________mol Ba(OH)2,沉淀的物质的量最大,离子方程式为______________________________________________。
(3)将上述反应中的Al2O3加入适量氧化铬,在氢氧焰上强热,熔融后使其结晶,可以制成人造红宝石,可用于做激光器材和装饰品。所得人造红宝石是哪种Al2O3的变体?怎样用简便方法说明它确实是该种Al2O3的变体?
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
氧化铝有两种变体,一种是α-Al2O3,另一种是γ-Al2O3。γ-Al2O3可用Al(OH)3在723 K时加热制得,它不耐酸。α-Al2O3是天然刚玉的主要成分,硬度大,且对酸有极强的稳定性。α-Al2O3可以用γ-Al2O3于高温煅烧制得。已知氧化铝可用铝铵明矾加热制得。铝铵明矾[NH4Al(SO4)2?12H2O]受热分解的产物为Al2O3、NH3、N2、SO2、SO3和H2O。
(1)写出铝铵明矾受热分解的化学方程式 。氧化产物是 ,还原产物是 ,它们的物质的量之比是 。
(2)在含1mol铝铵明矾的溶液中,需加入 mol Ba(OH)2,所得沉淀的物质的量最大,离子方程式为 。
(3)将上述反应中的Al2O3加入适量氯化铬,在氢氧焰上加强热,熔融后使结晶,可以制成红宝石,可用于做激光器材和装饰品。所得人造红宝石是哪种变体? ,怎样用简便的方法说明它确实是该种Al2O3变体查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com