
【题目】亚硝酸钠(NaNO2)是一种常见的食品添加剂。某兴趣小组用如图所示装置制备NaNO2并对其性质作如下探究(A中加热装置已略去)。

查阅资料可知:
①2NO+Na2O2=2NaNO2;2NO2+Na2O2 =2NaNO3。
②NO能被酸性KMnO4氧化成NO3-。
(1)A中滴入浓硝酸之前,应先通入N2一段时间,目的是____________。 A中反应的化学方程式_____________。
(2)装置B中观察到的主要现象______________。
(3)装置C中盛放的试剂是______________。
(4)装置E的作用是______________。
(5)写出NO被酸性KMnO4氧化的离子反应方程式______________。
【答案】 排尽装置中的空气,防止对后续实验有干扰 C+4HNO3![]() CO2↑+4NO2↑+2H2O 溶液变蓝,铜片溶解,有无色气体冒出 碱石灰(或生石灰或氢氧化钠固体) 吸收有毒气体NO,防止空气污染 5NO+3MnO4-+4H+=5NO3-+3Mn2++2H2O
CO2↑+4NO2↑+2H2O 溶液变蓝,铜片溶解,有无色气体冒出 碱石灰(或生石灰或氢氧化钠固体) 吸收有毒气体NO,防止空气污染 5NO+3MnO4-+4H+=5NO3-+3Mn2++2H2O
【解析】根据实验原理分析,本实验不能有氧气,要排除氧气的干扰,由实验装置可以知道,A中发生C+4HNO3![]() CO2↑+4NO2↑+2H2O ,B中吸收挥发的硝酸和生成的二氧化氮,C中固体干燥剂干燥NO,并除去可能混有的酸雾,D中发生2NO+Na2O2=2NaNO2,E中高锰酸钾吸收尾气NO,以此分析。
CO2↑+4NO2↑+2H2O ,B中吸收挥发的硝酸和生成的二氧化氮,C中固体干燥剂干燥NO,并除去可能混有的酸雾,D中发生2NO+Na2O2=2NaNO2,E中高锰酸钾吸收尾气NO,以此分析。
详解:(1)为了排除氧气干扰,A中滴入浓硝酸之前,应先通入一段时间N2;A中发生C+4HNO3![]() CO2↑+4NO2↑+2H2O,因此,本题正确答案是: 排尽装置中的空气,防止对后续实验有干扰; C+4HNO3
CO2↑+4NO2↑+2H2O,因此,本题正确答案是: 排尽装置中的空气,防止对后续实验有干扰; C+4HNO3![]() CO2↑+4NO2↑+2H2O;
CO2↑+4NO2↑+2H2O;
(2)B中水吸收二氧化氮将NO2转化为NO、二氧化氮溶于水生成硝酸,铜与稀硝酸反应生成NO,现象有:溶液变蓝,铜片溶解,有无色气体冒出;
因此,本题正确答案是: 溶液变蓝,铜片溶解,有无色气体冒出;
(3)C中盛放的试剂是用来干燥NO,并除去可能混有的酸雾,故应用碱石灰(或生石灰或氢氧化钠固体),因此,本题正确答案是: 碱石灰(或生石灰或氢氧化钠固体);
(4)由信息可以知道,E装置的作用是利用高锰酸钾溶液的强氧化性氧化吸收有毒气体一氧化氮,吸收有毒的NO气体,避免污染空气, 因此,本题正确答案是:吸收有毒气体NO,防止空气污染;
(5)根据信息:NO被酸性KMnO4氧化成NO3-,根据电子守恒和电荷守恒及原子守恒写出离子反应方程式为: 5NO+3MnO4-+4H+==5NO3-+3Mn2++2H2O,
因此,本题正确答案是: 5NO+3MnO4-+4H+==5NO3-+3Mn2++2H2O。


 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案科目:高中化学 来源: 题型:
【题目】下图是丁烷(C4H10)裂解的实验流程。连接好装置后,需进行的实验操作有:①检置整套装置的气密性②排出装置中的空气③给D、G装置加热等……;G后面装置以及铁架台等已省略;CuO能将烃氧化成CO2和H2O。
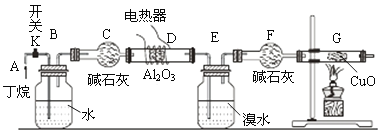
请回答下列问题:
(1)丁烷裂解的可能方程式为C4H10![]() CH4+C3H6,____________________;
CH4+C3H6,____________________;
(2)写出甲烷与氧化铜反应的化学方程式_____________________________;
(3)若对反应后E装置中的混合物(溴水足量),再按以下流程实验:
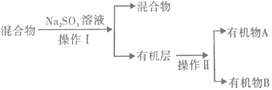
①分离操作Ⅰ和Ⅱ的名称分别是___________、___________(填字母) ;
a.蒸发 b.过滤 c.分液 d.蒸馏
②Na2SO3溶液的作用是(用离子方程式表示)_____________________________________________;
③已知A的碳原子数大于B的碳原子数,请写出B的名称______________________;
(4)假定丁烷完全裂解,流经D、G装置中的气体能完全反应。当(E+F)装置的总质量比反应前增加了0.49g,G装置的质量比反应间减少了1.44,则丁烷的裂解产物中甲烷和乙烷的物质的量之比为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图表示在一定的温度下,容积固定的密闭容器中,A、B、C三种气体物质的浓度随时间变化的情况,试回答下列问题:
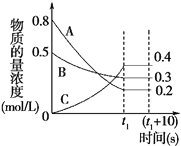
(1)该反应的化学方程式为_________________。
(2)0~t1s内B气体的平均反应速率为____________。
(3)(t1+10)s时,A的转化率为_____。
(4)关于该反应的说法正确的是_________。
a.到达t1时刻该反应已停止
b.在t1时刻之前B气体的消耗速率大于它的生成速率
c.在t1时刻C气体的正反应速率等于逆反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的熔、沸点高低顺序正确的是( )
A. 金刚石,晶体硅,二氧化硅,碳化硅 B. CI4>CBr4>CCl4>CH4
C. MgO>KCl>Hg>I2>O2 D. 金刚石>生铁>纯铁>钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是()
A.摩尔是物质的量的单位B.2mol水的摩尔质量36g/mol
C.阿伏加德罗常数是12g碳中所含有碳原子数D.阿伏加德罗常数符号为NA,通常用6.02×1023表示
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,回答下列有关问题:
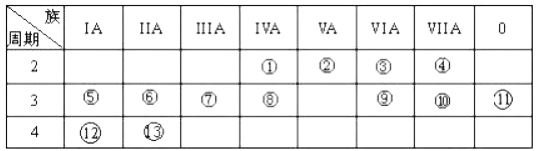
(1)写出下列元素名称:②_________;___________。
(2)在这些元素中,金属性最强的元素是______(用元素符号表示),元素⑨与元素⑩相比,非金属性较强的是___________(用元素符号表示)。下列表述中能证明这一事实的是______________。
a.常温下⑨的单质和⑩的单质状态不同
b. ⑩的氢化物比⑨的氢化物稳定
c.一定条件下⑨和⑩的单质都能与氢氧化钠溶液反应
(3)⑦的最高价氧化物对应水化物与⑩的最高价氧化物对应水化物反应的离子方程式为:______。
(4)②的气态氢化物与HC1在空气中相遇有白烟生成,写出白烟对应物质的电子式_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酰氯(ClNO)是有机物合成中的重要试剂,为红褐色液体或黄色气体,具有刺鼻恶臭味、遇水反应生成一种氯化物和两种氮化物。某学习小组在实验空用Cl2和NO制备ClNO并测定其纯度,相关实验装置(夹持装置略去)如下图所示。请回答:
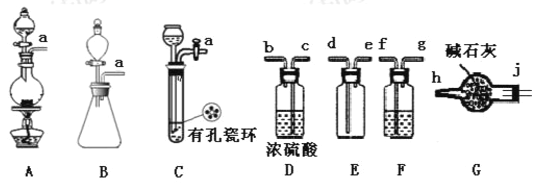
(1)制备C12发生装置可以选用____(填写字母代号),请写出发生反应的离子方程式:____________。
(2)欲收集一瓶干燥的氯气,选择装置,其连接顺序为:a→_______(按气流方向,用小写字母表示)。
(3)实验室可用下图装置制备亚硝酰氯(C1NO):
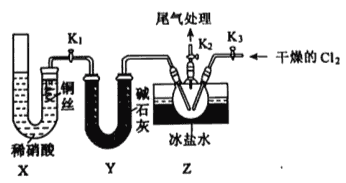
①实验室也可用B装置制备NO,X装置的优点为__________。
②检验装置气密性并装入药品,打开K2,然后再打开K1,通入一段时间气体,其目的为_______,然后进行其他操作,当Z有一定量液体生成时,停止实验。
③若无装置Y,则Z中C1NO可能发生反应的化学方程式为________。
(4)取Z中所得液体mg溶于水,配制成250mL溶液,取出25.00mL,以K2CrO4溶液为指示剂,用cmolL-1AgNO3标准溶液滴定至终点,消耗标准溶液的体积为22.50mL。则亚硝酰氯(C1NO)的质量分数为______(用代数式表示)。[已知:Ag2CrO4为砖红色固体;Ksp(AgCl)=1.56×10-10,Ksp(K2CrO4)=1×10-12]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烷烃相对分子质量为86,如果分子中含有3个—CH3、2个—CH2—和1个![]() ,则符合该结构的所有烷烃的一氯取代物总共有几种( )
,则符合该结构的所有烷烃的一氯取代物总共有几种( )
A. 10种 B. 9种 C. 8种 D. 7种
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com