


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关碳族元素的说法正确的是( )
①原子最外层电子数是4 ②碳与强氧化剂氯气反应时失去4个电子生成离子化合物四氯化碳 ③石墨在一定条件下转化为金刚石是化学变化 ④铅的熔点比锗高,锡的熔点比铅低 ⑤单质都是无色晶体 ⑥从CPb,其最高价氧化物对应水化物的酸性逐渐增强 ⑦除Pb外,其他元素的+4价化合物是稳定的 ⑧稳定性SiF4<CH4<H2O<HF⑨硅的非金属性比金属性强,而锗的金属性比非金属性强
A.①②③⑤⑧⑨ B.①③⑦⑧⑨ C.②④⑤⑥ D.全部
查看答案和解析>>
科目:高中化学 来源:2013-2014学年广东省惠州市高三第三次调研考试化学试卷(解析版) 题型:填空题
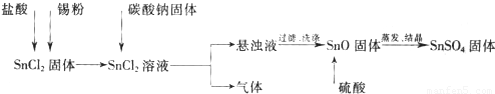
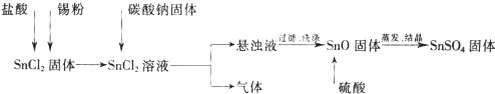
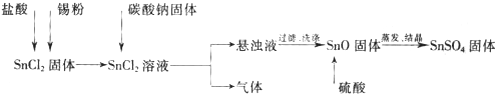
硫酸亚锡(SnSO4)可用于镀锡工业.某小组设计SnSO4制备路线为:

查阅资料:
Ⅰ.酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式,Sn2+易被氧化.
Ⅱ.SnCl2易水解生成碱式氯化亚锡
(1)锡原子的核电荷数为50,与碳元素同处ⅣA族,锡位于周期表的第 周期(1分)
(2)操作Ⅰ是 过滤、洗涤等(2分)
(3)溶解SnCl2粉末需加浓盐酸,原因是
(4)加入Sn粉的作用有两个:①调节溶液pH ②
(5)反应Ⅰ得到沉淀是SnO,得到该沉淀的离子反应方程式是
(6)酸性条件下,SnSO4与双氧水去反应的离子方程式是
(7)该小组通过下列方法测定所用锡粉的纯度(杂质不参与反应):
①将试样溶于盐酸中,发生的反应为:Sn+2HCl═SnCl2+H2↑;
②加入过量的FeCl3;
③用已知浓度的K2Cr2O7滴定②生成的Fe2+,再计算锡粉的纯度,请配平方程式:
FeCl2 + K2Cr2O7
+ HCl = FeCl3
+ KCl + CrCl2+

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com