
写出下列物质的电离方程式:
(1)次氯酸: _.
(2)硫酸氢钾 .
(3)氢氧化铁: .
(4)碳酸氢钠: .
考点:
电离方程式的书写.
专题:
离子反应专题.
分析:
写物质的电离方程式,首先判断电解质的类型及电离出的阴阳离子,然后根据电解质的类型判断写可逆号还是等号,如果是多元弱酸,要分步电离,如果是多元弱碱,只需一步书写,最后要注意原子守恒、电荷守恒,据此即可解答.
解答:
解:(1)次氯酸,为一元弱酸,部分电离,用可逆符号,电离出氢离子和次氯酸根离子,故答案为:HClO⇌H++ClO﹣;
(2)硫酸氢钾,是强酸强碱酸式盐,属强电解质,完全电离,用等号,电离出K+、H+、SO42﹣离子,故答案为:KHSO4=K++H++SO42﹣;
(3)氢氧化铁,为三元弱碱,部分电离,用可逆符号,多元弱碱,只需一步书写,电离出Fe3+、3OH﹣,故答案为:Fe(OH)3⇌Fe3++3OH﹣;
(4)碳酸氢钠是酸式盐,属强电解质,完全电离,电离出Na+、HCO3﹣,因碳酸为弱酸,所以在溶液中的阴离子为HCO3﹣,电离方程式为NaKHCO3=Na++HCO3﹣,故答案为:NaHCO3=Na++HCO3﹣.
点评:
本题考查了电离方程式的书写,题目难度不大,注意书写方法是解答本题的关键.


科目:高中化学 来源: 题型:
如图是关于反应A2(g)+3B2(g)⇌2C(g)△H<0的平衡移动图形,影响平衡移动的原因是( )
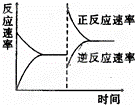
|
| A. | 升高温度,同时加压 |
|
| B. | 降低温度,同时减压 |
|
| C. | 增大反应物浓度,同时减小生成物浓度 |
|
| D. | 增大反应物浓度,同时使用催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
|
| A. | HCl溶液中无OH﹣ |
|
| B. | NaOH溶液中无H+ |
|
| C. | KCl溶液中既无OH﹣也无H+ |
|
| D. | 常温下,任何物质的水溶液中都有H+和OH﹣,且Kw=1×10﹣14 |
查看答案和解析>>
科目:高中化学 来源: 题型:
250℃和1.01×105Pa时,反应 2N2O5(g)=4NO2(g)+O2(g);△H=+56.76kJ•mol﹣1,自发进行的原因是( )
|
| A. | 是吸热反应 | B. | 是放热反应 |
|
| C. | 是熵减少的反应 | D. | 熵增大效应大于焓变效应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
可确认发生了化学平衡移动的是( )
|
| A. | 化学反应速率发生了改变 |
|
| B. | 有气态物质参加的可逆反应达到平衡后,改变了压强 |
|
| C. | 由于某一条件的改变,使平衡混合物中各组分的浓度发生了不同程度的改变 |
|
| D. | 可逆反应达到平衡后,使用催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
用中和滴定法测定某烧碱样品的纯度,试根据实验回答下列问题:
(1)准确称量8.2g含有少量中性易溶杂质的样品,配成500mL待测溶液.称量时,样品可放在 (填编号字母)上称量
(A)小烧杯 (B)洁净纸片 (C)直接放在托盘上
(2)滴定时,用0.2000mol•L﹣1的盐酸来滴定待测溶液,不可选用 (填编号字母)作指示剂.
(A)甲基橙 (B)石蕊 (C)酚酞
(3)根据你所选择的指示剂,正确判断滴定终点的现象是: .
(4)根据下表数据,计算被测烧碱溶液的物质的量浓度是 mol•L﹣1,烧碱样品的纯度是 97.56% .
| 滴定次数 | 待测溶液体积(mL) | 标准酸体积 |
|
| 滴定前的刻度(mL) | 滴定后的刻度(mL) | ||
| 第一次 | 10.00 | 0.40 | 20.50 |
| 第二次 | 10.00 | 4.10 | 24.00 |
(5)下列实验操作会对滴定结果产生的后果.(填“偏高”、“偏低”或“无影响”)
①观察酸式滴定管液面时,开始俯视,滴定终点平视,则滴定结果 .
②若将锥形瓶用待测液润洗,然后再加入10.00mL待测液,则滴定结果 .
查看答案和解析>>
科目:高中化学 来源: 题型:
下图是部分短周期元素化合价与原子序数的关系图(X、Y、Z、W、R代表元素符号)下列说法中,正确的是
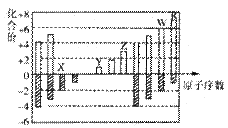
| A.原子半径比较: | B.气态氢化物的还原性比较:W>R |
| C.WX3和水反应形成的化合物是离子化合物 | D.含Z元素的盐溶液一定显示酸性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com