
下列物质中不能由单质直接化合生成的是
①CuS ②FeS ③SO3 ④H2O ⑤FeCl2 ⑥NH3
A.①③⑤ B.②④⑤ C.①②④⑤ D.①②③④⑤⑥
 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案科目:高中化学 来源:2015-2016学年山西省高二上12月月考化学试卷(解析版) 题型:选择题
在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
物质 | X | Y | Z |
初始浓度/mol·L-1 | 0.1 | 0.2 | 0 |
平衡浓度/mol·L-1 | 0.05 | 0.05 | 0.1 |
下列说法错误的是
A.反应达到平衡时,X的转化率为50%
B.反应可表示为X+3Y 2Z,其平衡常数为1600
2Z,其平衡常数为1600
C.增大压强可使平衡向生成Z的方向移动,平衡常数增大
D.改变温度可以改变此反应的平衡常数
查看答案和解析>>
科目:高中化学 来源:2016届辽宁省高三上学期期中测试化学试卷(解析版) 题型:实验题
某化学兴趣小组拟用右图装置制备氢氧化亚铁并观察其颜色。提供化学药品:铁屑、稀硫酸、氢氧化钠溶液。
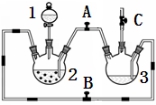
(1)稀硫酸应放在 中(填写仪器名称)。
(2)本实验通过控制A、B、C三个开关,将仪器中的空气排尽后,再关闭开关 、打开开关 就可观察到氢氧化亚铁的颜色为 。试分析实验开始时排尽装置中空气的理由 。
(3)实验时为防止仪器2中铁粉通过导管进入仪器3中,可采取的措施是 。
(4)在FeSO4溶液中加入(NH4)2SO4固体可制备摩尔盐晶体[(NH4)2SO4·FeSO4·6H2O] (相对分子质量392),该晶体比一般亚铁盐稳定,不易被氧化,易溶于水,不溶于乙醇。
①为洗涤(NH4)2SO4·FeSO4·6H2O粗产品,下列方法中最合适的是 。
A.用冷水洗
B.先用冷水洗,后用无水乙醇洗
C.用30%的乙醇溶液洗
D.用90%的乙醇溶液洗
②为了测定产品的纯度,称取a g产品溶于水,配制成500mL溶液,用浓度为c mol·L-1的酸性KMnO4溶液滴定。每次所取待测液体积均为25.00mL,实验结果记录如下:
实验次数 | 第一次 | 第二次 | 第三次 |
消耗高锰酸钾溶液体积/mL | 25.52 | 25.02 | 24.98 |
滴定过程中发生反应的离子方程式为 。滴定终点的现象是 。
通过实验数据计算的该产品纯度为 (用字母ac表示).上表中第一次实验中记录数据明显大于后两次,其原因可能是 。
A.实验结束时俯视刻度线读取滴定终点时酸性高锰酸钾溶液的体积
B.滴定前滴定管尖嘴有气泡,滴定结束无气泡
C.第一次滴定用的锥形瓶用待装液润洗过,后两次未润洗
D.该酸性高锰酸钾标准液保存时间过长,有部分变质,浓度降低
查看答案和解析>>
科目:高中化学 来源:2016届山东省高三上学期第二次诊断测试化学试卷(解析版) 题型:填空题
I.向100 mL FeI2溶液中逐渐通入Cl2,会依次生成I2、Fe3+、IO3-,其中Fe3+、I2的物质的量随n(Cl2)的变化如图所示,请回答下列问题:

(1)由图可知,I-、Fe2+、I2三种粒子的还原性由强到弱的顺序为________>________>________;
(2)按顺序写出通入Cl2过程中发生反应的离子方程式为
__________________________________________;
__________________________________________;
__________________________________________。
(3)当溶液中n(Cl-)∶n(IO3-)=8∶1时,通入的Cl2在标准状况下的体积为________。
II.新型净水剂高铁酸钾(K2FeO4)为暗紫色固体,可溶于水,在中性或酸性溶液中逐渐分解,在碱性溶液中稳定。生产K2FeO4的工艺流程如下图所示:

(1)写出“氧化”过程中生成Na2FeO4的化学方程式 。
(2)“转化”过程中发生的化学反应方程式为 。
查看答案和解析>>
科目:高中化学 来源:2016届山东省高三上学期第二次诊断测试化学试卷(解析版) 题型:选择题
下列实验操作、现象和结论均正确的是
选项 | 实验操作 | 现象 | 结论 |
A | 向苏打和小苏打溶液中分别加入盐酸 | 均冒气泡 | 两者均能与盐酸反应 |
B | 向AgNO3溶液中滴加过量氨水 | 溶液澄清 | Ag+与NH3·H2O能大量共存 |
C | 将可调高度的铜丝伸入到稀HNO3中 | 溶液变蓝 | Cu与稀HNO3发生置换反应 |
D | 将KI和FeCl3溶液在试管中混合后,加入CCl4,振荡,静置 | 下层溶液显紫红色 | 氧化性: I2> Fe3+ |
查看答案和解析>>
科目:高中化学 来源:2016届山东省高三上学期第二次诊断测试化学试卷(解析版) 题型:选择题
在由水电离产生的H+浓度为1×10-13 mol·L-1的溶液中,一定能大量共存的离子组是
①K+、Cl-、NO3-、S2-;
②K+、Fe2+、I-、SO42-;
③Na+、Cl-、NO3-、SO42-;
④Na+、Ca2+、Cl-、HCO3-;
⑤K+、Ba2+、Cl-、NO3-
A.①③ B.③⑤ C.③④ D.②⑤
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省高二12月月考化学试卷(解析版) 题型:选择题
25℃时,向10mL 0.01mol/L KOH溶液中滴加0.01mol/L苯酚溶液,混合溶液中粒子浓度关系正确的是
A.pH>7时,c(C6H5O﹣)>c(K+)>c(H+)>c(OH﹣)
B.pH<7时,c(K+)>c(C6H5O﹣)>c(H+)>c(OH﹣)
C.V=10mL时,c(K+)=c(C6H5O﹣)>c(OH﹣)=c(H+)
D.V=20mL时,c(C6H5O﹣)+c(C6H5OH)=2c(K+)
查看答案和解析>>
科目:高中化学 来源:2015-2016学年贵州遵义航天中学高二上第三次月考化学卷(解析版) 题型:?????
某化学反应的能量变化如下图所示。下列有关叙述正确的是( )

A.该反应的反应热ΔH=E2-E1
B.a、b分别对应有催化剂和无催化剂的能量变化
C.催化剂能降低反应的活化能
D.催化剂能改变反应的焓变
查看答案和解析>>
科目:高中化学 来源:2015-2016学年贵州遵义航天中学高一上第三次月考化学卷(解析版) 题型:填空题
(1)通常状况下,已知X、Y两种气体,其质量分别为a、b时,体积之比为2:3。 两种气体X、Y的相对分子质量之比为________; 相同条件下的X、Y两种气体,体积相同时,则X、Y的密度之比为__________;相同条件下,同质量的两种气体,X与Y的分子数之比为________。
(2)已知下列反应能发生:
2A3+ + 2B - = 2A2+ + B2 ;
C2 + 2B- = 2C- + B2 ;
2A2+ + C2 = 2A3++ 2C-
上述三个反应中氧化剂的氧化性强弱顺序为___________;还原剂的还原性强弱顺序为___________。
(3)一定条件下硝酸铵受热分解的化学方程式为: NH4NO3→HNO3+N2↑+H2O(未配平),写出配平后的化学方程式:________________________。在反应中被氧化与被还原的氮原子数之比为
(4)氧化还原反应在生产、生活中具有广泛的用途,贯穿古今。古诗词是古人为我们留下的宝贵精神财富,下列诗句不涉及氧化还原反应的是( )
A.野火烧不尽,春风吹又生
B.春蚕到死丝方尽,蜡炬成灰泪始干
C.粉身碎骨浑不怕,要留清白在人间
D.爆竹声中一岁除,春风送暖入屠苏
水是人体的重要组成部分,是人体中含量最多的一种物质。而“四种基本反应类型与氧化还原反应的关系”也可用下图表达。

试写出有水参加的符合反应类型Ⅳ的一个化学方程式___________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com