
 +④×
+④× 得C(s)+O2(g)═CO2(g),故△H1=△H2+
得C(s)+O2(g)═CO2(g),故△H1=△H2+ (△H3+△H4)
(△H3+△H4) (△H3+△H4);
(△H3+△H4);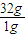 =726.4,故反应的热化学方程式为:CH3OH(l)+
=726.4,故反应的热化学方程式为:CH3OH(l)+ O2(g)═CO2(g)+2H2O(l)△H=-726.4kJ?mol-1,
O2(g)═CO2(g)+2H2O(l)△H=-726.4kJ?mol-1, O2(g)═CO2(g)+2H2O(l)△H=-726.4kJ?mol-1;
O2(g)═CO2(g)+2H2O(l)△H=-726.4kJ?mol-1; O2(g)═H2O(l)△H=-285.8kJ?mol-1,
O2(g)═H2O(l)△H=-285.8kJ?mol-1,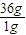 =88kJ,故氢气与氧气反应生成2mol气态水的反应热为△H=-(285.8×2-88)kJ/mol=-483.6kJ/mol,
=88kJ,故氢气与氧气反应生成2mol气态水的反应热为△H=-(285.8×2-88)kJ/mol=-483.6kJ/mol,

 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 1 |
| 2 |
| 3 |
| 2 |
| 3 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
I.(6分)把煤作为燃料可通过下列两种途径:
途径Ⅰ C(s)+O2(g)=====CO2(g);ΔH1<0 ①
途径Ⅱ 先制成水煤气:
C(s)+H2O(g)=====CO(g)+H2(g);ΔH2>0 ②
再燃烧水煤气:
2CO(g)+O2(g)=====2CO2(g);ΔH3<0 ③
2H2(g)+O2(g)=====2H2O(g); ΔH4<0 ④
请回答下列问题:
(1)途径Ⅰ放出的热量理论上_________(填“>”“=”或“<”)途径Ⅱ放出的热量。
(2)ΔH1、ΔH2、ΔH3、ΔH4的数学关系式是_______________。
(3)已知:① C(s)+O2(g)=CO2(g); DH=—393.5 kJ·mol-1
② 2CO(g)+O2(g)=2CO2(g); DH=-566 kJ·mol-1
③ TiO2(s)+2Cl2(g)=TiCl4(s)+O2(g); DH=+141 kJ·mol-1
则TiO2(s)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)的DH= 。
Ⅱ.(6分)(1) 在25℃、101 kPa下,1 g液态甲醇(CH3OH)燃烧生成CO2和液态水时放热22.7 kJ,则该反应的热化学方程式应为 。
(2).由氢气和氧气反应生成1 mol液态水时放热285.8 kJ,写出该反应的热化学方程式 ___________________ _________________。若1g水蒸气转化成液态水放热2.444 kJ,则反应2H2(g) + O2(g) === 2H2O(g)的△H= 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com