
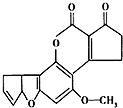
 黄曲霉素AFTB1(如图)是污染粮食的真菌霉素.人类的特殊基因在黄曲霉素的作用下会发生突变,有转变成肝癌的可能性.与1mol黄曲霉素起反应的H2或NaOH的最大量分别是( )
黄曲霉素AFTB1(如图)是污染粮食的真菌霉素.人类的特殊基因在黄曲霉素的作用下会发生突变,有转变成肝癌的可能性.与1mol黄曲霉素起反应的H2或NaOH的最大量分别是( )| A. | 6mol,2mol | B. | 7mol,2mol | C. | 6mol,1mol | D. | 7mol,1mol |
分析 在一定条件下能和氢气发生反应的有碳碳不饱和键、羰基、苯环,能和NaOH反应的为酯基水解生成的羧基和酚羟基,据此分析.
解答 解:在一定条件下能和氢气发生反应的有碳碳不饱和键、羰基、苯环,能和NaOH反应的为酯基水解生成的羧基和酚羟基,该分子中含有2个碳碳双键、1个苯环、1个羰基,所以1mol该物质最多能和6mol氢气发生加成反应,酯基水解生成酚羟基和羧基,酚羟基和羧基都能和NaOH反应,所以1mol该物质最多能和2molNaOH反应,故选A.
点评 本题考查有机物结构和性质,为高频考点,明确官能团及其性质关系是解本题关键,侧重考查烯烃、苯环、酯、酮的性质,注意该物质中含有苯环,为易错点.


 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案科目:高中化学 来源: 题型:选择题
| A. | H2O和H2O2互为同素异形体 | B. | O2和O3互为同位素 | ||
| C. | 乙醇和二甲醚互为同分异构体 | D. | 12C、13C为同一种核素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 黄铁矿被称“愚人金”,化学成分是FeS2,晶体属正方体晶系的硫化物矿物.室温为非活性物质.温度升高后变得活泼.在空气中氧化成三氧化二铁和二氧化硫,主要用于接触法制造硫酸:
黄铁矿被称“愚人金”,化学成分是FeS2,晶体属正方体晶系的硫化物矿物.室温为非活性物质.温度升高后变得活泼.在空气中氧化成三氧化二铁和二氧化硫,主要用于接触法制造硫酸:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第三周期第IA族 | B. | 第四周期第IA族 | C. | 第三周期第ⅡA族 | D. | 第四周期第ⅡA族 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 组别 | 10%硫酸体积/mL | 温度/℃ | 其它物质 |
| Ⅰ | 2mL | 20 | / |
| Ⅱ | 2mL | 20 | 10滴饱和MnSO4溶液 |
| Ⅲ | 2mL | 30 | / |
| Ⅳ | 1mL | 20 | 1mL蒸馏水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
| 第2周期 | ⑥ | ⑦ | ||||||
| 第3周期 | ① | ③ | ⑤ | ⑧ | ⑨ | ⑩ | ||
| 第4周期 | ② | ④ |
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com