


科目:高中化学 来源: 题型:
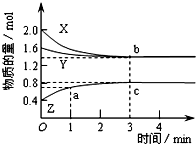 某温度时,在体积为2L的密闭容器中,X、Y、Z三种物质的物质的量随时间变化的曲线如图所示,其中a、b、c三点的坐标分别为(1,0.7)、(3,1.4)、(3,0.8).下列说法中正确的是( )
某温度时,在体积为2L的密闭容器中,X、Y、Z三种物质的物质的量随时间变化的曲线如图所示,其中a、b、c三点的坐标分别为(1,0.7)、(3,1.4)、(3,0.8).下列说法中正确的是( )| A、该反应的化学方程式是3X+Y=2Z |
| B、3 min时,X的转化率为70% |
| C、达平衡时,c(Y)=0.7 mol?L-1 |
| D、前1 min内,v(Z)=0.3 mol?L-1?min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.20 摩/升 |
| B、0.15 摩/升 |
| C、0.10 摩/升 |
| D、0.05 摩/升 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在化学反应中发生物质变化的同时,不一定发生能量变化 |
| B、△H>0表示放热反应,△H<0表示吸热反应 |
| C、放热反应,使体系的温度升高;吸热反应,使体系的温度降低 |
| D、生成物释放的总能量大于反应物吸收的总能量时,△H<0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 催化剂 |
| △ |
| A、2molSO2与1molO2能完全反应生成2molSO3,升高温度可以加快此反应的化学反应速率 |
| B、2molSO2与1molO2不能完全反应生成2molSO3,升高温度可以加快此反应的化学反应速率 |
| C、2molSO2与1molO2能完全反应生成2molSO3,升高温度减慢此反应的化学反应速率 |
| D、2molSO2与1molO2不能完全反应生成2molSO3,升高温度减慢此反应的化学反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
6 3 |
7 3 |
23 11 |
24 12 |
14 6 |
14 7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,22.4L汽油含有NA个分子 |
| B、5.6L甲烷中含有的电子数为2.5NA |
| C、标准状况下,80gSO3含有的氧原子数为3NA |
| D、1molFe完全反应,时区2NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| I1 | I2 | I3 | I4 | I5 | I6 | I7 |
| 14.5 | 29.6 | 47.4 | 77.5 | 97.9 | 551.9 | 666.8 |
| A、ⅡA | B、ⅢA | C、ⅤA | D、ⅣA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com